Нехай об'ємна частка азоту дорівнює х, тоді об'ємна частка амоніаку буде 1 - х. Рахуємо об'ємну частку азоту підклавши всі дані в наступну формулу
Якщо об'ємна частка азоту 7/11, то об'ємна частка амоніаку 4/11
Відношення 4 об'ємів амоніаку до 11 об'ємів суміші фактично відповідає відношенню 4 молей амоніаку до 11 молей суміші (дане відношення справедливе тільки для газів). Звідси можемо порахувати масову частку амоніаку
А) φ(N₂) = 7/11 ≈ 0.6364 = 63.64%
Б) w(NH₃) = 17/66 ≈ 0.2576 = 25.76%
Объяснение:
Найперше рахуємо молярну масу суміші
Нехай об'ємна частка азоту дорівнює х, тоді об'ємна частка амоніаку буде 1 - х. Рахуємо об'ємну частку азоту підклавши всі дані в наступну формулу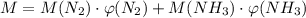
Якщо об'ємна частка азоту 7/11, то об'ємна частка амоніаку 4/11
Відношення 4 об'ємів амоніаку до 11 об'ємів суміші фактично відповідає відношенню 4 молей амоніаку до 11 молей суміші (дане відношення справедливе тільки для газів). Звідси можемо порахувати масову частку амоніаку
Объяснение:
Общие химические свойства кислот:
1) Действие на индикаторы
2) Взаимодействие с металлами, стоящими в ЭХР металлов до водорода:
Zn + H2SO4 = ZnSO4 + H2
3) Взаимодействие с основными и амфотерными оксидами:
Na2O + H2SO4 = Na2SO4 + H2O
BeO + H2SO4 = BeSO4 + H2O
4) Взаимодействие с основаниями:
2NaOH + H2SO4 = Na2SO4 + 2H2O
5) Взаимодействие с амфотерными гидроксидами:
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
6) Взаимодействие с солями, образованные слабыми к-тами:
СаСO3 + H2SO4 = CaSO4 + H2O + CO2↑
7) Некоторые специфические свойства к-т:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
AgNO3 + HCl = AgCl↓ + HNO3
Химические св-ва щелочей:
1) Действие на индикаторы;
2) Взаимодействие с кислотными оксидами:
2NaOH + CO2 = Na2CO3 + H2O
3) Взаимодействие с кислотами:
NaOH + HCl = NaCl + H2O
4) Взаимодействие с растворимыми в воде солями, катионы которых образуют нерастворимые в воде основания:
СuCl2 + 2KOH = Cu(OH)2↓ + 2KCl