Пля підживлення капусти використовують 3%-вий розчин калій хлориду
сі. Обчисліть масу солі калій хлориду KCl та об'єм води необхідні для
приготування такого розчину масою 25 кг.
(0,75 кг)
4. Для консервування огірків потрібно узяти 9%-ий розчин оцтової кислоти
(оцет). Обчисли масу оцтової есенції з масовою часткою оцтової кислоти
75%, яку потрібно взяти щоб приготувати розчин оцту масою 500 гз масовою
часткою кислоти 9%.
(60 г)
1. Обчисли масу води, яку потрібно додати до розчину натрій гідроксиду
NaOH масою 200 гз масовою часткою NaOH 5 %, щоб отримати розчин
натрій гідроксиду з масовою часткою NaOH 2%.
(300 г)
8. Обчисли масову частку речовини в розчині, що утворився при змішуванні
розчину солі масою 100 г масовою часткою солі 20% та розчину цієї ж солі
(25 %)
масою 20 г масовою часткою 50%.
2)ковалентная полярная
3) NO
4)
Количество аммиака = 1кг / (14+3) кмоль/кг = 58,82 моль
N₂ + 3H₂ --> 2NH₃
По реакции для этого необходимо минимум: 58,82/2 = 29,41 моль азота, что составляет 22,4*29,41 = 658,82 л
5)Добавление вещества с анионом OH⁻ (щелочь), при этом выделяется едкий газ (аммиак):
KOH + NH₄Cl --> KCl + NH₃ + H₂O
6) Оксид азота NO₂ (диоксид азота) — бурый газ, токсичен, тяжелее воздуха, легко сжижается. При комнатной температуре NO₂ находится в смеси с его бесцветным димером N₂O₄, приблизительно 1:1.
Взаимодействует с водой:
2NO₂ + Н₂О = HNO₃ + HNO₂
и растворами щелочей:
2NO₂ + 2NaOH = NaNO₃ + NaNO₂ + H₂О
Сильный окислитель. Многие вещества (угол, фосфор, органические соединения) могут гореть в NO₂. Этот оксид окисляет SO₂ до SO₃. Раздражает дыхательные пути, при больших концентрациях появляется отек легких.
7) Азот может образовывать несколько типов кислот: азотная, азотистая и азотистоводородная. Соответственно их соли: нитраты (KNO₃, Cu(NO₃)₂), нитриты (KNO₂, Ca(NO₂)₂) и азиды (KN₃, AgN₃)
1.кислородсодержащие органические соединения, в которых атом Водорода, замещен на одну карбоксильную группу, называются предельные одноосновные кислоты.
2.муравьиную кислоту можно получить действием на ее соли более сильными кислотами,например,серной.А ее соль можно получить,пропуская угарный газ через нагретую щелочь
3.Фенол обладает следующими физическими свойствами:бесцветное кристаллическое вещество со специфическим запахом,температурой плавления 42,3 градуса по Цельсию,температурой кипения 181,1 градуса,довольно трудно растворим в воде,на воздухе окисляется(краснеет) и кристаллы его расплываются.
4.область применения формальдегида:в производстве пластмасс,в кожевенном деле для дубления кожи,медицине и санитарии - для дезинфекции,40%-водный раствор называют формалином и применяют в семеноводстве для протравливания зерна от грибковых заболеваний
№2 составить формулу: 3-этилгептаналь:
7 6 5 4 3 2 1
| |
№3 закончить уравнение следующих реакций, укажите условия протекания, назовите вещества:
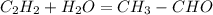 (в присутствии раствора сульфата ртути)- реакция Кучерова
(в присутствии раствора сульфата ртути)- реакция Кучерова
С2Н2--->СН3СОН--->С2Н5ОН--->НСООС2Н5
1)
2)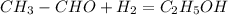 (в присутствии никеля)
(в присутствии никеля)
3)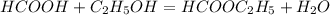 (при незначительном нагревании в присутствии концентрированной серной кислоты)
(при незначительном нагревании в присутствии концентрированной серной кислоты)