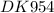Дано:
m(Fe₂O₃) = 80 гр
Q = 423,63 кДж/моль
ΔH°(Al) = 0 кДж/моль
ΔH°(Fe) = 0 кДж/моль
ΔH°(Al₂O₃) = -1676 кДж/моль
---------------------------------------------------
Найти:
ΔH°(Fe₂O₃) - ?
1) Для начала мы напишем уравнение реакций из условия задачи:
2Al + Fe₂O₃ → Al₂O₃ + 2Fe ΔH(х.р.) - ?
2) Далее мы находим количества вещества у оксида железа (III):
M(Fe₂O₃) = 56×2 + 16×3 = 112 + 48 = 160 гр/моль
n(Fe₂O₃) = m(Fe₂O₃)/M(Fe₂O₃) = 80 гр / 160 гр/моль = 0,5 моль
3) Далее находим количества вещества у химической реакций:
Q / n(Fe₂O₃) = Q(х.р.) / n(х.р.)(Fe₂O₃)
Q(х.р.) = (Q × n(х.р.)(Fe₂O₃)) / n(Fe₂O₃) = (423,63 кДж/моль × 1 моль) / 0,5 моль = 423,63 кДж / 0,5 моль = 847,26 кДж/моль
4) Теперь находим энтальпию в химической реакций:
ΔH(х.р.) = -Q(х.р.) ⇒ ΔH(х.р.) = -847,26 кДж/моль
5) Далее находим теплоту образования Fe₂O₃ при нахождения энтальпий у химической реакций:
ΔH(х.р.) = ∑H°(пр.р.) - ∑H°(исх.в-в) , отсюда мы получаем:
ΔH(х.р.) = (ΔH°(Al₂O₃) + 2ΔH°(Fe)) - (2ΔH°(Al) + ΔH°(Fe₂O₃))
Так как из табличного значения известно что ΔH°(Al) = 0 кДж/моль , и ΔH°(Fe) = 0 кДж/моль , следовательно:
ΔH(х.р.) = ΔH°(Al₂O₃) - ΔH°(Fe₂O₃) , следовательно:
ΔH°(Fe₂O₃) = ΔH°(Al₂O₃) - ΔH(х.р.) = -1676 кДж/моль - (-847,26 кДж/моль) = -1676 кДж/моль + 847,26 кДж/моль = -828,74 кДж/моль
ответ: ΔH°(Fe₂O₃) = -828,74 кДж/моль
Решено от :
2.
x 50g
Zn+H2SO4=ZnSO4+H2
65g 98g
x=50*65/98=33g
3.m(FeSO4)=500*0.1=50g
4.
v=0.44-0.22/12min=0/02mol/L*min
5.
xmol 4g
2H2O=2H2+O2
2mol 32g
x=2*4/32=0.25mol
6.m(NaCl)=300*0.05=15g
7.mNi=2000*0.12=240kg
mCr=2000*0.08=160kg
mFe=2000*0.8=1600kg
8.
10L xL
N2+3H2=2NH3
1mol 3mol
x=10*3/1=30L
9.
27g 14g xg
CuCl2+Fe=FeCl2+Cu
135g 56g 64g
nCuCl2=27/135=0.2mol
nFe=14/56=0.25molв избытке
ч=27*64.135=12.8g
10. VO2=500*0.21=105m(3)
VN2=500*0.78=390m(3)
11.
11.2L xL
N2+3H2=2NH3
22.4L 44.8L
x=11.2*44.8/22.4=22.4L
12. MCxSe=38*2=79g/mol
nC=15.8/12=1.26 nS=84.2/32=2.6
1.26:2.6=1:2
CS2
13.M=1.69*22.4=38g/mol
D(H2)=38/2=19 F2
14.
xg 11g
CaCO3=CaO+CO2
100g 44g
x=100*11/44=25g
w=25/30*100%=83%
15.
xL yL 0.2mol
2H2 +O2= 2H2O
44.8L 22.4L 2mol
x=44.8*0.2/2=4.48L
y=22.4*0.2/2=2.24L
16. mcem=200*0.3=60kg
mpes=200*0.7=140kg
17.mr-ra=47.5+2500=2547.5g
w=2500/2547.5*100%=98%
18.
1kg xmol
S+O2=SO2 2SO2+O2=2SO3
32g 1mol
x(SO2)=1000*1/32=31.25mol
x(SO3)=2nSO2=31.25*2=62.5mol
19.mKOH=56*1.5=84g
mr-ra=84*1.05=88.2g
wKOH=84/88.2*100%=95.2%
20. гремучая ртуть Hg(CNO)2*0.5H2O
21.
5.6L xL
N2+3H2=2NH3
22.4L 44.8L
x=5.6*44.8/22.4=11.2L
22. a) Dvozd/H2=29/2=14.5
b) Dv/v=29/29=1
23.M=1.25*22.4=28g/mol
24.
422g xg
MgCO3=MgO+CO2
84g 40g
x=422*40/84=201g
w=19/2018100%=9.5%
25. mC=4.4*12/44=1.2g
mH=2.7*2/18=0.3g
M=1.59*29=133g/mol
С:Н=1.2/12 : 0.3/1=1:3
n(CH3)=133
n*15=133
n=9
C9H20 нонан
Дано:
m(Fe₂O₃) = 80 гр
Q = 423,63 кДж/моль
ΔH°(Al) = 0 кДж/моль
ΔH°(Fe) = 0 кДж/моль
ΔH°(Al₂O₃) = -1676 кДж/моль
---------------------------------------------------
Найти:
ΔH°(Fe₂O₃) - ?
1) Для начала мы напишем уравнение реакций из условия задачи:
2Al + Fe₂O₃ → Al₂O₃ + 2Fe ΔH(х.р.) - ?
2) Далее мы находим количества вещества у оксида железа (III):
M(Fe₂O₃) = 56×2 + 16×3 = 112 + 48 = 160 гр/моль
n(Fe₂O₃) = m(Fe₂O₃)/M(Fe₂O₃) = 80 гр / 160 гр/моль = 0,5 моль
3) Далее находим количества вещества у химической реакций:
Q / n(Fe₂O₃) = Q(х.р.) / n(х.р.)(Fe₂O₃)
Q(х.р.) = (Q × n(х.р.)(Fe₂O₃)) / n(Fe₂O₃) = (423,63 кДж/моль × 1 моль) / 0,5 моль = 423,63 кДж / 0,5 моль = 847,26 кДж/моль
4) Теперь находим энтальпию в химической реакций:
ΔH(х.р.) = -Q(х.р.) ⇒ ΔH(х.р.) = -847,26 кДж/моль
5) Далее находим теплоту образования Fe₂O₃ при нахождения энтальпий у химической реакций:
ΔH(х.р.) = ∑H°(пр.р.) - ∑H°(исх.в-в) , отсюда мы получаем:
ΔH(х.р.) = (ΔH°(Al₂O₃) + 2ΔH°(Fe)) - (2ΔH°(Al) + ΔH°(Fe₂O₃))
Так как из табличного значения известно что ΔH°(Al) = 0 кДж/моль , и ΔH°(Fe) = 0 кДж/моль , следовательно:
ΔH(х.р.) = ΔH°(Al₂O₃) - ΔH°(Fe₂O₃) , следовательно:
ΔH°(Fe₂O₃) = ΔH°(Al₂O₃) - ΔH(х.р.) = -1676 кДж/моль - (-847,26 кДж/моль) = -1676 кДж/моль + 847,26 кДж/моль = -828,74 кДж/моль
ответ: ΔH°(Fe₂O₃) = -828,74 кДж/моль
Решено от :