ответ: ответ ниже. "⇒" и "=" заменить на стандартную "стрелочку" в химии.
Объяснение:
159) a)N( Степень окисления была -3, так как азот связан с тремя водородами, степень окисления которых равна +1) ⇒ N (степень окисления +2, так как связан с кислородом, степень окисления которого равна -2) ; Было -3, а стало +2, значит, N отдал 5 электрона.
б) O ( в 0 степени окисления, так как не связан больше ни с каким элементом) ⇒ O ( - 2 степень окисления, так как связан с двумя водородами, чья степень окисления равна +2) ; Было 0, а стало -2, значит, O получил 2 электрона.
(1-(окисление азота) и (восстановление кислорода)
Там 5 электронов, а здесь 2 электрона. Приводим к наименьшему общему кратному, домножая первую часть уравнения на 2, а вторую - на 5. Получаем (К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
В 161 всё аналогично. Сразу перейду к коэффициентам
,( к окислению идёт коэффициент 2, а к восстановителю 3), что в молекулярной формуле 4NH3+3O2⇒ 2N2 + 6 H2O
ответ: ответ ниже. "⇒" и "=" заменить на стандартную "стрелочку" в химии.
Объяснение:
159) a)N( Степень окисления была -3, так как азот связан с тремя водородами, степень окисления которых равна +1) ⇒ N (степень окисления +2, так как связан с кислородом, степень окисления которого равна -2) ; Было -3, а стало +2, значит, N отдал 5 электрона.
б) O ( в 0 степени окисления, так как не связан больше ни с каким элементом) ⇒ O ( - 2 степень окисления, так как связан с двумя водородами, чья степень окисления равна +2) ; Было 0, а стало -2, значит, O получил 2 электрона.
Там 5 электронов, а здесь 2 электрона. Приводим к наименьшему общему кратному, домножая первую часть уравнения на 2, а вторую - на 5. Получаем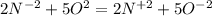 (К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
(К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
В 161 всё аналогично. Сразу перейду к коэффициентам
ответ: ω%(ZnCO3) = 10*100 / 14 =71,4%
ω%(Na2CO3) = 100-71,4=28,6%
Объяснение:Разлагается только карбонат цинка:
ZnCO₃→ZnO+CO₂
Найдем количество вещества углекислого газа
ν(СО₂)=1,792:22,4=0,08моль
Значить ν(СО2)=ν(ZnO)=ν(ZnCO₃) =0,08моль
ZnO реагирует с щелочью:
ZnO + 2NaOH + Н2O = Na2[Zn(OH)4]
ν(NaOHпрореаг.) = 2ν(ZnO) = 0,16 моль
Найдем итоговую массу раствора:
m(NaOH итог)=m(NaOHр-р) + m(ZnO) + m(Na2CO3) (1)
m(NaOHобщ)=0,16*40+0,0796*100,46=14,4 г
Масса исходного раствора щелочи:
14,4*100/16=90г
По тождество (1) найдем массу карбоната натрия:
m(Na2CO3)=100,48-90- m(ZnO)=10,48-6,48=4г
Находим массу карбоната цинка:
ν(ZnCO3) = ν(ZnO) = 0,08 моль
m(ZnCO3) = 0,08 · 125 = 10 г
Общая масса смеси:
10+4=14г
ω(ZnCO3) = 10*100 / 14 =71,4%
ω(Na2CO3) = 100-71,4=28,6%