При электролизе водного раствора электролита (электроды инертные) на одном из электродов выделился газ Вr2 количеством n=0,05 моль. 1. Составьте электронные уравнения электродных процессов.
2. Вычислите массу вещества, выделившегося на втором электроде электролизера.
3. Определите, какие вещества могут образоваться в прикатодном или прианодном пространстве, и вычислите их массы.
1) Са → СаО → Са(ОН)2 → Ca(NO3)
2Сa + O2 = 2CaO
CaO + H2O = Ca(OH)2
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
2) Сu → СuО → СиСl2 → Сu(ОН)
2Сu + O2 = 2CuO
CuO + H2O = Cu(OH)2
Cu(OH)2 + 2HCl= CuCl2 + 2H2O
3) Mg → MgO → MgCl2 → MgSO4
2Mg + O2 = 2MgO
MgO + 2HCl = MgCl2 + H2O
MgCl2 + Na2SO4 = MgSO4 + 2NaCl
4) Fe2(SO4)3 → Fe(OH)3 → Fe2O3 → Fe2(SO4)3
Fe2(SO4)3 + 6KOH = Fe(OH)3 + 3K2SO4
2Fe(OH)3 = Fe2O3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
5) Zn → ZnCl2 → Zn(OH)2 → ZnO
Zn + Cl2 = ZnCl2
ZnCl2 + 2KOH = Zn(OH)2 + 2KCl
Zn(OH)2 = ZnO + H2O
6) Сu → CuO → CuCl2 ↓ → CuSO4
2Cu + O2 = 2CuO
CuO + 2HCl = CuCl2 + H2O
CuCl2 + K2SO4 = CuSO4 + 2KCl
7) Si → SiO2 → Na2SiO3 → H2SiO3
Si + O2 = SiO2
SiO2 + Na2O = Na2SiO3
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl
8) H2SO3 → Na2SO3 → SO2 → CaSO3
H2SO3 + 2NaBr = Na2SO3 + 2HBr
Na2SO3 = Na2O + SO2
SO2 + CaO = CaSO3
остальное устала печатать
1.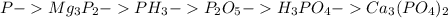
1)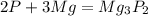
2)
3)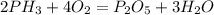
4)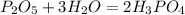
5)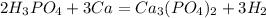
2.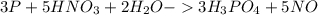
окисление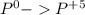 (-5e) восстановитель |5|3
(-5e) восстановитель |5|3
восстановление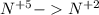 (+3e) окислитель |3|5
(+3e) окислитель |3|5
3. Дано:
m(P)=31кг
________________________________
m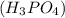 =?
=?
0,2 x
3кмоль 3кмоль
mчист.(P)=31кг*0,2=6,2кг
n(P)=6,2кг/31кг/кмоль=0,2кмоль
m(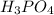 )=0,2кмоль*98кг/кмоль=19,6кг
)=0,2кмоль*98кг/кмоль=19,6кг
m(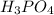 )=19,6кг*08=15,68 кг
)=19,6кг*08=15,68 кг
ответ: 15,68кг