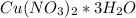Так как при прокаливании нитрата происходит его разложение,то имеем такое уравнение реакции:
х г 2 г
376 г 160 г
1.Найдем массу нитрата,который разложился и который находился в кристаллогидрате до прокаливания:
при взаимодействии 376 г нитрата образуется 160 г твердого остатка(оксида), а
при --//--//-- х г___________________2 г, откуда
х=376*2/160=4,7 г
2. Определим массу 1 моль кристаллогидрата:
Если 6,05 г кристаллогидрата содержит 4,7 г нитрата, то
у г___________________________188 г, откуда у=6,05*188/4,7=242 г
3. Найдем массу воды в 1 моль кристаллогидрата,отняв от массы кристаллогидрата массу сульфата:
m(H2O)=m(кристал.)-m(Cu(NO3)2)=242-188=54 г
4. Осталось определить количество молекул воды(количество вещества)в кристаллогидрате:
n(H2O)=m(H2O)/M(H2O)=54/18=3
Вот и выходит формула кристаллогидрата:
Так как при прокаливании нитрата происходит его разложение,то имеем такое уравнение реакции:
х г 2 г
376 г 160 г
1.Найдем массу нитрата,который разложился и который находился в кристаллогидрате до прокаливания:
при взаимодействии 376 г нитрата образуется 160 г твердого остатка(оксида), а
при --//--//-- х г___________________2 г, откуда
х=376*2/160=4,7 г
2. Определим массу 1 моль кристаллогидрата:
Если 6,05 г кристаллогидрата содержит 4,7 г нитрата, то
у г___________________________188 г, откуда у=6,05*188/4,7=242 г
3. Найдем массу воды в 1 моль кристаллогидрата,отняв от массы кристаллогидрата массу сульфата:
m(H2O)=m(кристал.)-m(Cu(NO3)2)=242-188=54 г
4. Осталось определить количество молекул воды(количество вещества)в кристаллогидрате:
n(H2O)=m(H2O)/M(H2O)=54/18=3
Вот и выходит формула кристаллогидрата: