1-г, 2-б, 3-в, 4-а, 5-б, 6-а, 7-г, 8-в, 9-а,г,
10 - -с ярко выраженными кислотными свойствами
11. - вещество А - оксид фосфора(V)
- вещество В - ортофосфорная кислота
х л у л 3 моль
12.
22,4 л 22,4 л 2 моль
а) при взаимодействии 22,4 л водорода образуется 2 моль хлороводорода, а
при -- // -- х л_____________________3 моль, откуда
х=22,4*3/2= 33,6 л
б) так как из уравнения видно,что объемные части реагирующих газов равны,значит:
х=у=33,6 л
13. Белый,красный и черный
Это делается путём прибавления к металлам кислотных остатков.
Берём натрий и составляем соли, используя таблицу растворимости, где есть строка с кислотными остатками, конечно, учитывая валентности.
1) NaCl; NaBr; NaJ; Na2S; NaNO3; Na2SO3; Na2SO4; Na3PO4; Na2CO3; Na2SiO3
2) KCl; KBr; KJ; K2S; KNO3; K2SO3; K2SO4; K3PO4; K2CO3; K2SiO3
3) BeCl2; BeBr2; BeJ2; Be(NO3)2; BeSO3; BeSO4; Be3(PO4)2; По таблице растворимости не все соли существуют с берилием
4) CaCl2; CaBr2; CaJ2; CaS; Ca(NO3)2; CaSO3; CaSO4; Ca3(PO4)2; CaCO3; CaSiO3
И т.д.
1-г, 2-б, 3-в, 4-а, 5-б, 6-а, 7-г, 8-в, 9-а,г,
10 -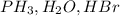 -с ярко выраженными кислотными свойствами
-с ярко выраженными кислотными свойствами
11.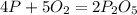 - вещество А - оксид фосфора(V)
- вещество А - оксид фосфора(V)
х л у л 3 моль
12.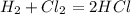
22,4 л 22,4 л 2 моль
а) при взаимодействии 22,4 л водорода образуется 2 моль хлороводорода, а
при -- // -- х л_____________________3 моль, откуда
х=22,4*3/2= 33,6 л
б) так как из уравнения видно,что объемные части реагирующих газов равны,значит:
х=у=33,6 л
13. Белый,красный и черный
Это делается путём прибавления к металлам кислотных остатков.
Берём натрий и составляем соли, используя таблицу растворимости, где есть строка с кислотными остатками, конечно, учитывая валентности.
1) NaCl; NaBr; NaJ; Na2S; NaNO3; Na2SO3; Na2SO4; Na3PO4; Na2CO3; Na2SiO3
2) KCl; KBr; KJ; K2S; KNO3; K2SO3; K2SO4; K3PO4; K2CO3; K2SiO3
3) BeCl2; BeBr2; BeJ2; Be(NO3)2; BeSO3; BeSO4; Be3(PO4)2; По таблице растворимости не все соли существуют с берилием
4) CaCl2; CaBr2; CaJ2; CaS; Ca(NO3)2; CaSO3; CaSO4; Ca3(PO4)2; CaCO3; CaSiO3
И т.д.