пригадайте реакцію добування кисню в лабораторії з калій нітрату та укажіть масу калій нітрату, яка, потрібна для добування 61,5л кисню за температури 300 К
а) Проведём качественную реакцию на гидроксид-ион. Для этого воспользуемся индикаторами. Гидроксид кальция - основание малорастворимое, но тем не менее некоторое количество растворяется, следовательно среду изменять будет. Возьмём индикатор фенолфталеин, добавим его в пробирку с гидроксидом кальция, в результате раствор частично изменит цвет на малиновый - следовательно среда щелочная (слабощелочная).
б) Проведём качественную реакцию на сульфат-ион. Для этого возьмём любую растворимую соль бария (по стандарту - хлорид бария), добавим его в раствор с сульфатом аммония. В ходе реакции выпадает белый осадок - сульфат бария. Реакция выглядит следующим образом:
ᅠᅠ
2. Испытайте растворы нитрата натрия, карбоната натрия и нитрата цинка раствором индикатора или индикаторной бумагой, и объясните результаты испытаний. Запишите молекулярные и ионные уравнения реакций гидролиза:
1. Нитрат натрия - соль, образованная сильным основанием NaOH и сильной кислотой HNO₃, гидролиз протекать не будет, среда нейтральная. Это можно доказать следующим путём: возьмём индикатор метиловый оранжевый, добавим его в раствор нитрата натрия, в результате цвет изменится на оранжевый. Это и есть признак нейтральной среды.
2. Карбонат натрия - соль, образованная сильным основанием NaOH и слабой кислотой H₂CO₃. Гидролиз протекает по аниону, образующаяся среда - щелочная, гидролиз обратимый, протекает в две стадии:
ᅠᅠ
ᅠᅠ
Добавим в раствор метиловый оранжевый. Раствор поменяет цвет на жёлтый, следовательно реакция среды щелочная.
3. Нитрат цинка - соль, образованная слабым основанием Zn(OH)₂ и сильной кислотой HNO₃. Гидролиз протекает по катиону, образующаяся среда - кислая, гидролиз обратимый, протекает в две стадии:
ᅠᅠ
ᅠᅠ
Добавим в раствор метиловый оранжевый. Раствор поменяет цвет на красный, следовательно реакция среды кислая.
3. Практически осуществите все следующие превращения:
1. Получим сульфат железа путём реакции железа и разбавленной серной кислоты:
ᅠᅠ
С точки зрения ОВР:
ᅠᅠ
ᅠᅠ | 2 | 1 | окисление
ᅠᅠ | 2 | 1 | восстановление
ᅠᅠFe - восстановитель, H₂SO₄ (2H⁺) - окислитель.
2. Получим гидроксид железа путём реакции сульфата железа и гидроксида калия:
ᅠᅠ
3. Получим хлорид железа путём реакции гидроксида железа и хлороводородной кислоты:
ᅠᅠ
4. Получим нитрат железа путём реакции хлорида железа и азотной кислоты:
т.к. Mg стоит во второй группе хим. элементов его валентность будет равна II (валентность обозначается римскими цыфрами), а Cl стоит в седьмой группе - его валентность мы определяем следующим образом: 8 (кол-во групп) - 7 (та группа, в которой стоит сам хлор) = 1 валентность хлора
дальше расставляем полученные значения над элементами и просто используем "правило крест-накрест", т.е. валентность Mg будет обозначать кол-во атомов хлора (цифра, что расположена внизу) в данном хим. соединении, а валентность хлора - кол-во атомов Mg
Примечание: подобное правило работает не во свех хим. формулах
1. Докажите опытным путём состав: а) гидроксида кальция; б) сульфата аммония.
а) Проведём качественную реакцию на гидроксид-ион. Для этого воспользуемся индикаторами. Гидроксид кальция - основание малорастворимое, но тем не менее некоторое количество растворяется, следовательно среду изменять будет. Возьмём индикатор фенолфталеин, добавим его в пробирку с гидроксидом кальция, в результате раствор частично изменит цвет на малиновый - следовательно среда щелочная (слабощелочная).
б) Проведём качественную реакцию на сульфат-ион. Для этого возьмём любую растворимую соль бария (по стандарту - хлорид бария), добавим его в раствор с сульфатом аммония. В ходе реакции выпадает белый осадок - сульфат бария. Реакция выглядит следующим образом:
ᅠᅠ
2. Испытайте растворы нитрата натрия, карбоната натрия и нитрата цинка раствором индикатора или индикаторной бумагой, и объясните результаты испытаний. Запишите молекулярные и ионные уравнения реакций гидролиза:
1. Нитрат натрия - соль, образованная сильным основанием NaOH и сильной кислотой HNO₃, гидролиз протекать не будет, среда нейтральная. Это можно доказать следующим путём: возьмём индикатор метиловый оранжевый, добавим его в раствор нитрата натрия, в результате цвет изменится на оранжевый. Это и есть признак нейтральной среды.
2. Карбонат натрия - соль, образованная сильным основанием NaOH и слабой кислотой H₂CO₃. Гидролиз протекает по аниону, образующаяся среда - щелочная, гидролиз обратимый, протекает в две стадии:
ᅠᅠ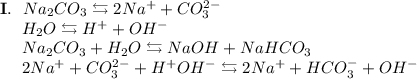
ᅠᅠ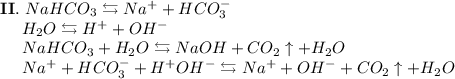
Добавим в раствор метиловый оранжевый. Раствор поменяет цвет на жёлтый, следовательно реакция среды щелочная.
3. Нитрат цинка - соль, образованная слабым основанием Zn(OH)₂ и сильной кислотой HNO₃. Гидролиз протекает по катиону, образующаяся среда - кислая, гидролиз обратимый, протекает в две стадии:
ᅠᅠ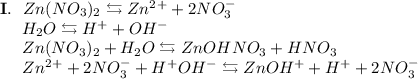
ᅠᅠ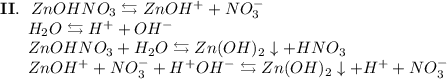
Добавим в раствор метиловый оранжевый. Раствор поменяет цвет на красный, следовательно реакция среды кислая.
3. Практически осуществите все следующие превращения: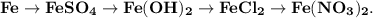
1. Получим сульфат железа путём реакции железа и разбавленной серной кислоты:
ᅠᅠ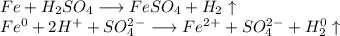
С точки зрения ОВР:
ᅠᅠ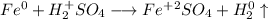
ᅠᅠ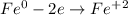 | 2 | 1 | окисление
| 2 | 1 | окисление
ᅠᅠ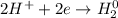 | 2 | 1 | восстановление
| 2 | 1 | восстановление
ᅠᅠFe - восстановитель, H₂SO₄ (2H⁺) - окислитель.
2. Получим гидроксид железа путём реакции сульфата железа и гидроксида калия:
ᅠᅠ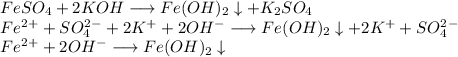
3. Получим хлорид железа путём реакции гидроксида железа и хлороводородной кислоты:
ᅠᅠ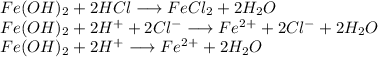
4. Получим нитрат железа путём реакции хлорида железа и азотной кислоты:
II I
MgCl₂
Объяснение:
т.к. Mg стоит во второй группе хим. элементов его валентность будет равна II (валентность обозначается римскими цыфрами), а Cl стоит в седьмой группе - его валентность мы определяем следующим образом: 8 (кол-во групп) - 7 (та группа, в которой стоит сам хлор) = 1 валентность хлора
дальше расставляем полученные значения над элементами и просто используем "правило крест-накрест", т.е. валентность Mg будет обозначать кол-во атомов хлора (цифра, что расположена внизу) в данном хим. соединении, а валентность хлора - кол-во атомов Mg
Примечание: подобное правило работает не во свех хим. формулах