Закончите уравнения возможных реакций. Кратко укажите причины протекания реакций.
1. Н 2 О + Р2О 5 = 2НРО3
Реакция возможна как взаимодействие кислотного оксида с водой
2. Н 3 РО 4 (р-р) + Ag =/=
3. Аl(ОН) 3 + КОН (р-р) = K[Al(OH)4]
Реакция возможна как взаимодействие амфотерного гидроксида со щелочью
4. H 2 SO 4 + СаО = СаSO4 + H2O
Реакция возможна как взаимодействие основного оксида с раствором кислоты
5. SO 3 + НСl =/=
6.2LiOH + CO 2 = Li2CO3 + H2O
Реакция возможна как взаимодействие кислотного оксида с раствором щелочи.
7. Zn(OH) 2 > ZnO + H2O
Реакция возможна так как многие нерастворимые в воде основания разлагаются при нагревании.
8. Na 2 SiO 3 + Fe(NO3 ) 2 = FeSiO3↓ + 2NaNO3
Реакция возможна так как многие метасиликаты двухвалентных металлов в воде не растворимы и выпадают в осадок.
9. Ba(OH) 2 + CuCl2 = Сu(OH)2↓ + BaCl2
Реакция возможна так как многие катионы двух и трех валентных металлов под действием растворов щелочей выпадают в осадок в виде нерастворимых оснований
По условии дано, что в 100 единиц массы вещества содержится 47,4% меди и 52,6% хлора. Находим число атомов каждого элемента в 100 единицах вещества, делим их числа на относительные атомные массы:
Определим соотношение чисел атомов в формуле вещества:
x : y = 0,74 : 1,48 = 1 : 2
Следовательно мы получаем формулу соли - CuCl₂.
б) Запишем формулу соли
По условии дано, что в 100 единиц массы вещества содержится 34,5% железа и 65,5% хлора. Находим число атомов каждого элемента в 100 единицах вещества, делим их числа на относительные атомные массы:
Объяснение:
Закончите уравнения возможных реакций. Кратко укажите причины протекания реакций.
1. Н 2 О + Р2О 5 = 2НРО3
Реакция возможна как взаимодействие кислотного оксида с водой
2. Н 3 РО 4 (р-р) + Ag =/=
3. Аl(ОН) 3 + КОН (р-р) = K[Al(OH)4]
Реакция возможна как взаимодействие амфотерного гидроксида со щелочью
4. H 2 SO 4 + СаО = СаSO4 + H2O
Реакция возможна как взаимодействие основного оксида с раствором кислоты
5. SO 3 + НСl =/=
6.2LiOH + CO 2 = Li2CO3 + H2O
Реакция возможна как взаимодействие кислотного оксида с раствором щелочи.
7. Zn(OH) 2 > ZnO + H2O
Реакция возможна так как многие нерастворимые в воде основания разлагаются при нагревании.
8. Na 2 SiO 3 + Fe(NO3 ) 2 = FeSiO3↓ + 2NaNO3
Реакция возможна так как многие метасиликаты двухвалентных металлов в воде не растворимы и выпадают в осадок.
9. Ba(OH) 2 + CuCl2 = Сu(OH)2↓ + BaCl2
Реакция возможна так как многие катионы двух и трех валентных металлов под действием растворов щелочей выпадают в осадок в виде нерастворимых оснований
10. MgSO 4 + NaCl =/=
Дано:
а) ω(Cu) = 47,4%
ω(Cl) = 52,6%
б) ω(Fe) = 34,5%
ω(Cl) = 65,5%
--------------------------------
Найти:
а) формулу соли - ?
б) формулу соли - ?
а) Запишем формулу соли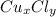
По условии дано, что в 100 единиц массы вещества содержится 47,4% меди и 52,6% хлора. Находим число атомов каждого элемента в 100 единицах вещества, делим их числа на относительные атомные массы:
Пусть m(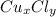 ) = 100 гр, тогда:
) = 100 гр, тогда:
m(Cu) = ω(Cu)×m(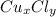 )/100% = 47,4% × 100 гр/100% = 0,474 × 100 гр = 47,4 гр
)/100% = 47,4% × 100 гр/100% = 0,474 × 100 гр = 47,4 гр
m(Cl) = ω(Cl)×m(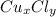 )/100% = 52,6% × 100 гр/100% = 0,526 × 100 гр = 52,6 гр
)/100% = 52,6% × 100 гр/100% = 0,526 × 100 гр = 52,6 гр
M(Cu) = 64 гр/моль M(Cl) = 35,5 гр/моль
x = m(Cu)/M(Cu) = 47,4/64 ≈ 0,74 - атомов меди (Cu)
y = m(Cl)/M(Cl) = 52,6/35,5 ≈ 1,48 - атомов хлора (Cl)
Определим соотношение чисел атомов в формуле вещества:
x : y = 0,74 : 1,48 = 1 : 2
Следовательно мы получаем формулу соли - CuCl₂.
б) Запишем формулу соли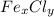
По условии дано, что в 100 единиц массы вещества содержится 34,5% железа и 65,5% хлора. Находим число атомов каждого элемента в 100 единицах вещества, делим их числа на относительные атомные массы:
Пусть m(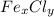 ) = 100 гр, тогда:
) = 100 гр, тогда:
m(Fe) = ω(Fe)×m(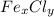 )/100% = 34,5% × 100 гр/100% = 0,345 × 100 гр = 34,5 гр
)/100% = 34,5% × 100 гр/100% = 0,345 × 100 гр = 34,5 гр
m(Cl) = ω(Cl)×m(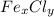 )/100% = 65,5% × 100 гр/100% = 0,655 × 100 гр = 65,5 гр
)/100% = 65,5% × 100 гр/100% = 0,655 × 100 гр = 65,5 гр
M(Fe) = 56 гр/моль M(Cl) = 35,5 гр/моль
x = m(Fe)/M(Fe) = 34,5/56 ≈ 0,62 - атомов меди (Fe)
y = m(Cl)/M(Cl) = 65,5/35,5 ≈ 1,85 - атомов хлора (Cl)
Определим соотношение чисел атомов в формуле вещества:
x : y = 0,62 : 1,85 ≈ 1 : 3
Следовательно мы получаем формулу соли - FeCl₃.
ответ: а) CuCl₂ ; б) FeCl₃