Процессы кристаллизации сплавов протекают: а) значительно сложнее чем у простых металлов б) значительно проще чем у простых металлов в)сходны с процессами кристаллизации просто металлов г)все указанные ответы
Хоть задача на украинскому, но я отвечу на русском. Надеюсь, что Вы поймёте.
Для начала найдём массовую долю брома: (100-17,82-3)%=79,18%
Для того, чтобы вывести эмпирическую(элементарную) формулу вещества, определим их соотношение:
Тогда, основываясь на вычислениях выше, составляем эмпирическую формулу:
Молекулярная масса данного вещества(эмпирического) равна:
Найдём молекулярную массу вещества, которое зашифровано через относительную плотность по водороду
Так как эмпирическая молекулярная масса совпадает с молекулярной массой конечного газа, то мы имеем право утверждать, что брутто-формула вещества следующая:
Под этой формулой может быть зашифровано несколько веществ:
1,2-дибромпропан
1,1-дибромпропан
1,3-дибромпропан
и т.д.
Нарисуем структурные формулы двух первых веществ(вложение):
§ 1. Понятие об электролизе
Проведем следующий опыт. Поместим в раствор хлорида меди(II) две
металлические пластинки, подключенные к источнику постоянного тока. В
результате будут наблюдаться следующие явления:
1. Электрод, заряженный отрицательно (катод), постепенно покрывается
красным налетом меди.
2. На электроде, заряженном положительно (анод), образуются пузырьки
газа – хлора (см. рисунок).
Электролиз раствора хлорида меди(II)
Объясняется это следующим образом. Хлорид меди(II) CuCl2 в водном
растворе диссоциирует на ионы:
CuCl2 → Cu2+ + 2Cl
При пропускании электрического тока через этот раствор положительно
заряженные катионы меди (Cu2+) движутся к отрицательно заряженному
электроду – катоду. Достигнув катода, ионы меди принимают электроны,
превращаясь в атомы меди:
Катод( ): Cu2+ + 2ē Cu
Отрицательно заряженные анионы хлора (Cl ) движутся к
положительно заряженному электроду – аноду. Достигнув анода, ионы хлора отдают электроны, превращаясь в атомы хлора, а затем в молекулы Cl2,
который выделяется в виде газа:
Анод(+): 2Cl 2 ē 2Cl Cl2↑
Сложим записанные уравнения, и получим ионное уравнение реакции,
протекающей при пропускании электрического тока через раствор хлорида
меди(II):
Cu2+ + 2Cl
электролиз
Cu + Cl2↑
Уравнение протекающей реакции в молекулярной форме:
CuCl2
электролиз
Cu + Cl2↑
В результате пропускания электрического тока через раствор хлорида
меди(II) протекает окислительно-восстановительная реакция, в результате
которой катионы меди восстанавливаются до металла, анионы хлора –
окисляются с образованием простого вещества хлора.
Электрический ток проводят не только растворы электролитов, но также
расплавленные соли, щелочи и оксиды металлов, при этом также происходят
окислительно-восстановительные реакции. Такой процесс называется
электролизом.
Электролиз — окислительно-восстановительный процесс,
протекающий при прохождении электрического тока через раствор либо
расплав электролита
При электролизе катод(–) имеет отрицательный заряд, к нему
движутся положительно заряженные катионы, которые принимают
электроны и восстанавливаются.
Анод(+) – электрод, который имеет положительный заряд, к нему
движутся отрицательно заряженные анионы, они отдают электроны аноду и
окисляются.
§ 2. Электролиз расплавов
В расплавах солей, так же, как и в их растворах, присутствуют катионы
металла и анионы кислотного остатка. Не все соли могут образовывать
расплавы. Например, некоторые соли при нагревании разлагаются
(карбонаты, нитраты, соли аммония). В то же время для ряда солей
электролиз их расплавов вполне осуществим, и даже используется в
промышленности. Это в основном электролиз расплавов хлоридов щелочных
и щелочноземельных металлов.Рассмотрим электролиз расплава NaCl, который применяется в
процессе промышленного получения натрия и хлора. Температура плавления
NaCl составляет 801 0С. В расплаве хлорида натрия имеются катионы натрия
и анионы хлора. При пропускании электрического тока катионы натрия
движутся к катоду, принимают электроны и восстанавливаются до
металлического натрия; анионы хлора – к аноду, отдают электроны и
окисляются сначала до атомарного хлора, затем образуются молекулы Cl2.
Запишем уравнения катодного и анодного процессов.
Катод( ): Na+
+ ē Na
Анод(+): 2Cl 2ē 2Cl Cl2↑
Суммарное уравнение:
2NaCl(расплав)
электролиз
2Na + Cl2↑
Электролиз расплава хлорида кальция (tпл. = 772 0С) используется в
промышленности для получения металлического кальция:
CaCl2 (расплав)
электролиз
Ca + Cl2↑
Обратите внимание, что самопроизвольно подобные реакции протекать
не могут! Наоборот, щелочные и щелочноземельные металлы активно
соединяются с галогенами (следовательно, при обычных условиях должны
протекать обратные реакции). Таким образом, в процессах электролиза для
осуществления невозможных при обычных условиях реакций используется
энергия электрического тока.
Основной промышленный получения алюминия – электролиз
расплава оксида алюминия
2Al2O3 (расплав)
электролиз
4Al + 3O2↑
Температура плавления Al2O3 чрезвычайно высока и составляет 2050 0С.
В связи с этим в процессе промышленного получения алюминия используют
не оксид алюминия, а смесь Al2O3 с криолитом Na3AlF6, температура
плавления которой существенно ниже (950 0С).
Хоть задача на украинскому, но я отвечу на русском. Надеюсь, что Вы поймёте.
Для начала найдём массовую долю брома: (100-17,82-3)%=79,18%
Для того, чтобы вывести эмпирическую(элементарную) формулу вещества, определим их соотношение: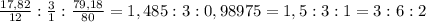
Тогда, основываясь на вычислениях выше, составляем эмпирическую формулу:
Молекулярная масса данного вещества(эмпирического) равна:
Найдём молекулярную массу вещества, которое зашифровано через относительную плотность по водороду
Так как эмпирическая молекулярная масса совпадает с молекулярной массой конечного газа, то мы имеем право утверждать, что брутто-формула вещества следующая: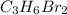
Под этой формулой может быть зашифровано несколько веществ:
1,2-дибромпропан
1,1-дибромпропан
1,3-дибромпропан
и т.д.
Нарисуем структурные формулы двух первых веществ(вложение):