2. в стакан або пробiрку (яка закриватиметься газoвiдвiдною трубкою ) кладем соду (Na2HCO3) або крейду СаСО3 та додаэм кислоту (будь-яку) в результатi бурхливоï реакцiï буде видiлятись газ СО2 Трубку опускаэмо у стакан з. розчином гашеного вапна (Са(ОН)2) . CO2 + Ca(oh)2 - CaCO3 + h2o. При пропусканні у вапняну воду вуглекислого газу розчин стає каламутним внаслідок утворення нерозчинного карбонату кальцію, а при надлишку СО2 розчин знову стає прозорим в результаті перетворення нормального карбонату в розчинний гідрокарбонат кальцію:
Са(ОН)2 + СО2 → СаСО3 + Н2О СаСО3 + Н2О + СО2 → Са(НСО3)2 кислотний характер Вуглекислого газу
Са(ОН)2 + СО2 → СаСО3 + Н2О
СаСО3 + Н2О + СО2 → Са(НСО3)2
кислотний характер Вуглекислого газу
1. a) CaO,
в)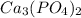
б) HCl
г)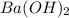
д)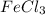
2. Азотная кислота, оксид алюминия (3), гидроксид кальция, сульфат магния, ортофосфорная кислота
3.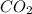 , MgO,
, MgO, 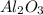 ,
, 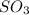 ,
, 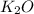
4. В первом +3(промежуточная), во втором -3(низшая), в третьем +5(высшая), в четвертом +2(промежуточная).
5. Решим простую математическую задачу: 200л(полный объем воздуха) * 21%(о,21) = 42 л кислорода
6. Найдём массу1 сахара = о,2 * 80 = 16 кг
найдем массу сахара2 = 16 + 15 = 31 кг
найдем массу раствора2 = 80 + 15 = 95 кг
И новая массовая доля равна: 31/95 * 100% (масса вещества/массу раствора) = 32,63 % или 33%