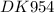Реактивы: соляная кислота, хлорид натрия, хлорид кальция, карбонат натрия, гидроксид натрия, серная кислота, сульфат натрия, сульфат магния, карбонат калия, гидроксид калия, азотная кислота, хлорид бария, хлорид железа (III), карбонат кальция, карбонат магния, сульфат меди (II), нитрат свинца (II), оксид меди (II), оксид магния, нитрат серебра.
1. Пользуясь выданными вам реактивами, получите осадки сульфата свинца (III) и гидроксида меди (II), раствор хлорида магния. Напишите уравнения этих реакций в молекулярном, полном и сокращённом ионном виде.
2. Пользуясь выданными вам реактивами, проведите реакции, выражаемые следующими сокращённо-ионными уравнениями:
(Фотография, II вариант)
3. В пяти пронумерованных пробирках находятся растворы следующих веществ:
Серная кислота, сульфат натрия, сульфат магния, карбонат калия, гидроксид калия.
Опытным путём определите вещества в пробирках. Напишите уравнения реакций.
Хим. св-ва:
1. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый– тоже в красный цвет.
2. Реакция нейтрализации (кислота+основание)
Обязательным условием протекания реакции является выделение слабо диссоциирующего вещества (напр., H20), осадка или газа.
H2SO4+Ca(OH)2=CaSO4+2 H2O
3. Взаимодействие кислот с основными оксидами. Поскольку основные оксиды – ближайшие родственники оснований – с ними кислоты также вступают в реакции нейтрализации:
2 HCl+CaO=CaCl2+H2O
4. Взаимодействие с металлами (кроме золота, серебра, меди, ртути).
2 HCl 2 Na=2 NaCl+H22.Оксиды - соединение двух химических элементов, одним из которых обязательно должен быть кислород в степени окисления -2.
Хим. св-ва основных оксидов:
1.Взаимодействие с водой:
- взаимодействие с водой с образованием основания (или щёлочи)
CaO+H2O = Ca(OH)2 (известная реакция гашения извести, при этом выделяется большое количества тепла!)
2. Взаимодействие с кислотами:- взаимодействие с кислотой с образованием соли и воды (раствор соли в воде)
CaO+H2SO4 = CaSO4+ H2O (Кристаллы этого вещества CaSO4 известны всем под названием "гипс").
3. Взаимодействие с кислотными оксидами: образование соли
CaO+CO2=CaCO3 (Это вещество известно всем - обычный мел!) Хим. св-ва кислотных оксидов:1. химическая реакция с водойCO2+H2O=H2CO3 - это вещество - угольная кислота - одна из слабых кислот, её добавляют в газированную воду для "пузырьков" газа. С повышением температуры растворимость газа в воде уменьшается, а его излишек выходит в виде пузырьков.2. реакция с щелочами (основаниями):CO2+NaOH=Na2CO3 - образовавшееся вещество (соль) широко используется в хозяйстве. Её название - кальцинированная сода или стиральная сода, - отличное моющее средство для подгоревших кастрюль, жира, пригара. Голыми руками работать не рекомендую!3. реакция с основными оксидами:CO2+MgO=MgCO3 - получившая соль - карбонат магния - ещё называется "горькая соль".3. (наверное соли?)Соль с точки зрения ТЭД сложное вещество, распадающееся в водном растворе на катион металла и анион кислотного остатка.
Свойства:
1.Взаимодействие с индикаторами.Лакмус синеет.
2.Разложение при нагревании
СаСO3 СаO + СО2.
3. Взаимодействие с кислотами: Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок.
2HCl + Na2CO3 ® 2NaCl + CO2 + H2O
4. Взаимодействие со щелочами
CuSO4 + 2NaOH ® Cu(OH)2¯ + Na2SO4
5. Взаимодействие друг с другом
AgNO3 + NaCl ® AgCl¯ + NaNO3
6. Взаимодействие с металлами
Fe + CuSO4 ® Cu¯ + FeSO4
7. Электролиз (разложение под действием постоянного электрического тока).
8. Взаимодействие с кислотными оксидами.
СО2 + Na2SiO3 ® Na2CO3 + SiO2
K₂Cr₂O₇ + KNO₂ + H₂SO₄ → Cr₂(SO₄)₃ + KNO₃ + K₂SO₄ + H₂O
2K⁺ + Cr₂O₇²⁻ + K⁺ + NO₂⁻ + 2H⁺ + SO₄²⁻ → 2Cr³⁺ + 3SO₄²⁻ + K⁺ + NO₃⁻ + 2K⁺ + SO₄²⁻ + H₂O
Cr₂O₇²⁻ + NO₂⁻ + 2H⁺ → 2Cr³⁺ + NO₃⁻ + H₂O
Cr₂O₇²⁻ + 14H⁺ + 6e⁻ → 2Cr³⁺ + 7H₂O | 6 | | 1 | - окислитель
| | 6 | |
NO₂⁻ + H₂O - 2е⁻ → NO₃⁻ + 2H⁺ | 2 | | 3 | - восстановитель
---------------------------------------------------------------------------------------------------------
Cr₂O₇²⁻ + 14H⁺ + 6e⁻ + 3NO₂⁻ + 3H₂O - 6е⁻ → 2Cr³⁺ + 7H₂O + 3NO₃⁻ + 6H⁺
Cr₂O₇²⁻ + 3NO₂⁻ + 8H⁺ → 2Cr³⁺ + 4H₂O + 3NO₃⁻
2K⁺ + Cr₂O₇²⁻ + 3K⁺ + 3NO₂⁻ + 8H⁺ + 4SO₄²⁻ → 2Cr³⁺ + 3SO₄²⁻ + 3K⁺ + 3NO₃⁻ + 2K⁺ + SO₄²⁻ + 4H₂O
В итоге получаем:
K₂Cr₂O₇ + 3KNO₂ + 4H₂SO₄ → Cr₂(SO₄)₃ + 3KNO₃ + K₂SO₄ + 4H₂O
Далее мы где решали уравнение полуреакций мы их находим в табличном значений, потом находим ЭДС и в итоге определим самопроизвольного протекания реакции между ними:
E(окислителя) = 1,33 В E(восстановителя) = 0,84 В
ε = E(окислителя) - E(восстановителя) = 1,33 В - 0,84 В = 0,49 В
ΔG = -ε = -(+0,49 В) = -0,49 В - протекает самопроизвольно
Теперь находим констант равновесия из полуреакций по уравнению Нернста:
lg K = ( n×(E(окислителя) - E(восстановителя) ) / 0,059 , где
n - общее число электронов
lg K = ( 6×(1,33 - 0,84) ) / 0,059
lg K = ( 6×0,49 ) / 0,059
lg K = 2,94 / 0,059
lg K ≈ 49,83 ⇒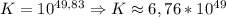
ответ: ε = 0,49 В, ΔG = -0,49 В ,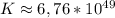
Решено от :