У нас здесь протекает две реакции - лития с водой, и кальция с водой, составим их уравнения:
ᅠᅠ
ᅠᅠ
Сначала нужно будет найти объём выделившегося водорода в первой и во второй реакции, а затем, чтобы узнать общий объём выделившегося водорода (что и требуют в условии), мы просто их сложим.
Работаем с первой реакцией. Сначала найдём количество вещества лития:
ᅠᅠ моль
Теперь по уравнению реакции найдём количество вещества водорода:
ᅠᅠ моль
Зная количество вещества водорода, найдём его объём:
ᅠᅠ литра
Теперь работаем со второй реакцией. Сначала найдём количество вещества кальция:
ᅠᅠ моль
По уравнению реакции найдём количество вещества водорода:
ᅠᅠ моль
Исходя из данного количества вещества найдём объём водорода:
ᅠᅠ литра
Мы нашли объём водорода, выделившегося по отдельности в первой и во второй реакции. Теперь найдём общий объём водорода:
Химия осыған дейін өздерің оқып үйренген география, биология, физика сияқты жаратылыстану ғылымдарының бірі. Мұнан баска химия ғылымы геология, экология, т. б. ғылымдармен терең астасып жатады. Ғылым салаларының бұлай байланысып жатуы дүниенің біртұтастығынан, оны оқып білуге әр жағынан келуге болатындығын көрсетеді.
Химия ғылымының энергетикалық, экономиялық, экологиялық, ауыл шаруашылык, медициналық және тағам өндірісіндегі мәселелерді шешудегі маңызы да орасан зор.
Химия - заттар және олардың өзгерістері туралы ғылым. Заттар дегеніміз денелердің құраушылары, мысалы, күнделікті өмірде шыныдан, пластмассадан және металдан жасалған құйғыштар пайдаланылады (су, сүт, бензин құйғанда). Бір дене әр түрлі заттан жасалған. Физикалық денелер - бізді коршаған бұйымдар. Денелердің массасы мен көлемдері болады.
Дано:
m(Li) = 2,8г
m(Ca) = 2,0г
Найти: Vобщий(H₂) - ?
У нас здесь протекает две реакции - лития с водой, и кальция с водой, составим их уравнения:
ᅠᅠ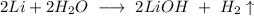
ᅠᅠ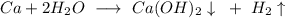
Сначала нужно будет найти объём выделившегося водорода в первой и во второй реакции, а затем, чтобы узнать общий объём выделившегося водорода (что и требуют в условии), мы просто их сложим.
Работаем с первой реакцией. Сначала найдём количество вещества лития:
ᅠᅠ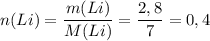 моль
моль
Теперь по уравнению реакции найдём количество вещества водорода:
ᅠᅠ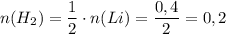 моль
моль
Зная количество вещества водорода, найдём его объём:
ᅠᅠ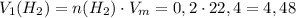 литра
литра
Теперь работаем со второй реакцией. Сначала найдём количество вещества кальция:
ᅠᅠ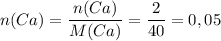 моль
моль
По уравнению реакции найдём количество вещества водорода:
ᅠᅠ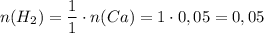 моль
моль
Исходя из данного количества вещества найдём объём водорода:
ᅠᅠ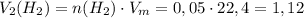 литра
литра
Мы нашли объём водорода, выделившегося по отдельности в первой и во второй реакции. Теперь найдём общий объём водорода:
ᅠᅠ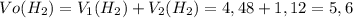 литра
литра
ответ: а) 5,6л.
Химия осыған дейін өздерің оқып үйренген география, биология, физика сияқты жаратылыстану ғылымдарының бірі. Мұнан баска химия ғылымы геология, экология, т. б. ғылымдармен терең астасып жатады. Ғылым салаларының бұлай байланысып жатуы дүниенің біртұтастығынан, оны оқып білуге әр жағынан келуге болатындығын көрсетеді.
Химия ғылымының энергетикалық, экономиялық, экологиялық, ауыл шаруашылык, медициналық және тағам өндірісіндегі мәселелерді шешудегі маңызы да орасан зор.
Химия - заттар және олардың өзгерістері туралы ғылым. Заттар дегеніміз денелердің құраушылары, мысалы, күнделікті өмірде шыныдан, пластмассадан және металдан жасалған құйғыштар пайдаланылады (су, сүт, бензин құйғанда). Бір дене әр түрлі заттан жасалған. Физикалық денелер - бізді коршаған бұйымдар. Денелердің массасы мен көлемдері болады.