Решить, не знаю как, а сдать надо. желательно подробно и с дано: на 20 г сплава цинка с медью, в котором массовая доля меди равна 35%, подействовали 70 г 30% раствора соляной кислоты. найдите объём выделившегося газа, учитывая, что доля выхода продукта реакции составляет 90% от теоретически возможного
Уравнение реакции( один из вариантов):
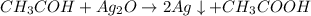
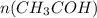 = 4,4 / 44= 0,1 моль
= 4,4 / 44= 0,1 моль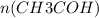 =
= 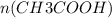 = 0,1 моль
= 0,1 моль
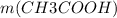 =
= 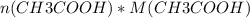 = 0,1 * 60 = 6 г.
= 0,1 * 60 = 6 г.
Чтобы расчитать выход продукта, нам нужно узнать сколько теоретически должно было выделиться продукта( "на бумаге").
Воспользуемся известной массой уксусного альдегида и найдём, сколько этого самого альдегида вступило в реакцию:
n( количество вещества) = m( масса) / M( молярная масса) - общая формула
Из уравнения реакции видно, что коэффициент перед уксусным альдегидом равен коэффициенту перед уксусной кислотой, т.е.
Теперь, пользуясь уже знакомой формулой n( количество вещества) = m( масса) / M( молярная масса), мы можем найти массу ( теоретическую) уксусной кислоты:
Выход продукта расчитываем по формуле:
w = m( практ) / m( теор) * 100% = 90%
ответ: выход продукта составил 90%.
2Ме(NO3)2 = 2 MeO + 4 NO2 + O2, то есть в ходе реакции из 1 моля Ме(NО3)2 получается 1 моль МеО, масса которого на 57,45% меньше массы исходного нитрата Ме(NО3)2.
1. Определим исходную массу неизвестного нитрата
57,45% это разность молекулярных масс исходного нитрата и оксида металла(твердый остаток)
на основе этого составим пропорцию
М Ме(NО3)2 - М(МеО) 57,45%
Х 100%
М Ме(NО3)2 можно представить выражением (Ме+(14+16*3)*2), а массу окида
выражением М(МеО)= (Ме+16), подставив в пропорцию получим:
(Ме+124) - (Ме +16) = 57,45%
Х100%, раскрыв скобки получим
Ме + 124 - Ме - 16 = 57,45%
Х 100%, отсюда Х= 108*100/57,45= 188 у.е.(г)
2. Определим из какого металла был нитрат
ММе(NО3)2 = Ме + (14+16*3)*2 = 188 - 124 = 64 у.е.(г) Масса элемента соответствует меди. Следовательно, неизвестный нитрат может быть представлен формулой Сu(NO3)2