Решить Вычислите относительную молекулярную * 1. массу следующих соединений: а) H2SO3, б) Al2S3, в) NaNO2, г) CaF2. * 2. Вычислите массовые доли элементов в следующих соединениях: а) Сао; б) Alcl3; в) Nacl. 3. Выведите простейшую формулу соединения, в котором массовая доля 43,66%, а массовая доля фосфора составляет кислорода - 56,34%.
ПОШАГОВОЕ РЕШЕНИЕ:
(1)
а)Mr(H2SO3)=2+32+48=82
б)Mr(Al2S3)=27×2+32×3=54+96=150
в)Mr(NaNO2)=23+14+32=69
г)Mr(CaF2)=40+38=78
(2)
Решае по следующей формуле:n=Ar/Mr
a)Mr(CaO)=56
n(Ca)=40/56=0,714 или 71,4%
n(O)=100%-71,4%=28,6%
б)Mr(AlCl3)=27+35,5×3=133,5
n(Cl)35,5×3/133,5=0,79 или 79%
n(Al) 100-79=29%
в)Mr(NaCl)=23+35,5=58,5
n(Cl)35,5/58,5=0,6 или 60%
n(Na)100-60=40%
(3)
P-43,66%
O-56,34%
(P) 31/43,66=0,71
(O) 16/56,34=0,28
перемножаем на 7,1
0,71×7,1=примерно5
0,28×7,1=примерно2
ответ:P2O5
Объяснение: №1. а) Mr(H2SO3)=1*2+32+16*3=2+32+48=82.
б) Mr(Al2S3)=27*2+32*3=54+96=150.
в) Mr(NaNO2)=23+14+16*2=23+14+32=69.
г) Mr(CaF2)=40+19*2=40+38=78.
№2. а) 1) Mr(CaO)=40+16=56.
2) W(Ca)=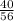 =0,70=70%.
=0,70=70%.
3) W(O)=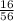 =0,30=30%.
=0,30=30%.
б) 1) Mr(AlCl3)=27+35*3=27+105=132.
2) W(Al)=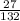 =0,20=20%.
=0,20=20%.
3) W(Cl3)=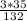 =
=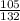 =0,80=80%.
=0,80=80%.
в) 1) Mr(NaCl)=23+35=58.
2) W(Na)=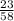 =0,40=40%.
=0,40=40%.
3) W(Cl)=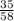 =0,60=60%.
=0,60=60%.
№3. Возьмем 100 грамм этого соединения, тогда масса фосфора 43.66 г, масса кислорода 56.34 г .
Найдем количества вещества:
ню(Р) = 43.66/31 = 1.4 моль .
ню(О) = 56.34/16 = 3.5 моль .
1.4:3.5 разделим на 1.4 будет 1:2.5 умножим на 2 получим 2:5 .
Формула: P2O5 .