Решите:
1) Запишите уравнения реакций, с которых можно осуществить следующие превращения:
а) магний → оксид магния → карбонат магния → гидроксид магния → оксид магния → магний
б) азот → оксид азота (V) → азотная кислота → нитрат магния
2) Рассчитайте объём оксида азота (V), необходимого для получения 126 г азотной кислоты.
1) а) 1. 2Mg + O₂ -> 2MgO
2. MgO + CO₂ -> MgCO₃
3. MgCO₃ + 2NaOH -> Mg(OH)₂ + Na₂CO₃
4. Mg(OH)₂ -> MgO + H₂O
5. MgO + C -> CO + Mg
б) 1. 2N₂ + 5O₂ -> 2N₂O₅
2. N₂O₅ + H₂O -> 2HNO₃
3.8 HNO₃ + 3Mg -> 3Mg(NO₃)₂ + 4H₂O + 2NO
2) Дано:
m(HNO₃) = 126г
Найти:
V(N₂O₅) - ?
Записываем уравнение реакции:
N₂O₅ + H₂O -> 2HNO₃
Находим количество вещества азотной кислоты:
M(HNO₃) = 1 + 14 + 3 × 16 = 63г/моль
n(HNO₃) =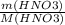 =
= 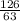 = 2 моль
= 2 моль
Находим количество вещества оксида азота:
Находим Объём оксида азота:
V(N₂O₅) = n(N₂O₅) × Vm = 1 моль × 22,4 л/моль = 22,4 л
ответ: 22,4 л
Объяснение: