Сначала находим количество вещества оксида кальция:
, где M(CaO) - молярная масса CaO, которая считается как сумма атомных масс Ca и O (даны в таблице Менделеева)
г/моль
моль
По реакции видно, что оксида кальция в 2 раза больше, чем затраченного кислорода (по коэффициентам смотрим: у CaO 2, у O₂ 1). Поэтому и количество вещества у кислорода будет в 2 раза меньше, чем у оксида кальция:
моль
Объем считаем по формуле:
, где - молярный объем, который для всех газов при н.у. равен 22,4 л/моль.
Масса воды - 120 г.
Масса щелочи - 40 г.
Находим массовую долю растворенного вещества в полученном растворе.
Для этого используем следующую формулу.
W = mр.в / mр-ра × 100 %.
Где m р.в - это масса растворимого вещества.
m р-ра - это масса раствора.
W - массовая доля.
Находим массу раствора.
m р-ра = m (воды) + m (щелочи ) = 120 г + 40 г = 160 г.
Далее находим массовую долю растворенного вещества.
W = 40г/160 г × 100 % = 25 %.
Значит, массовая доля растворенного вещества равна 25 процентов.
ответ: W = 25 %.
(только подставь свои цифры и посчитай со своими условиями)
22,4
Объяснение:
Дано:
m(CaO) = 112 г
Найти:
V(O₂) = ?
Реакция: 2Ca + O₂ → 2CaO
Сначала находим количество вещества оксида кальция:
По реакции видно, что оксида кальция в 2 раза больше, чем затраченного кислорода (по коэффициентам смотрим: у CaO 2, у O₂ 1). Поэтому и количество вещества у кислорода будет в 2 раза меньше, чем у оксида кальция:
Объем считаем по формуле:
Подставляем и решаем:
ответ: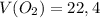 л
л