Сила кислоты определяется ее отделять протоны. В HF существуют водородные связи, что образования димеров , поэтому протоны отсоединяются плохо и HF слабая кислота. Вода, насколько мы знаем вообще кислота такая себе, в том смысле, что она, конечно отделять протоны (это называется автопротолиз воды), но кислота более сильная. Аммиак же еще худшая кислота, чем вода, вернее сказать, он вообще является основанием: у молекулы аммиака есть неподеленная пара электронов, которую она при желании может поместить на пустую орбиталь протона, что и характеризует ее как молекулу основания.
Верными являются варианты 2 и 4. HI, как ни странно, одна из самых сильных кислот. Она сильнее кислоты HBr, потому что сила межяжерного притяжения протона и йода меньше, чем протона и брома (бром более электроотрицателен), следовательно в HI протон уходит лучше, значит и кислота сильнее. 4 вариант вы отметили абсолютно верно является слабой кислотой даже при диссоциации по первой ступени.
S2+2H2=2H2S
2S+4H=4H(+)+2S(-2)
ОВР :
Восстановление:S + 2e− = S2− 1
Окисление:H − 1e− = H+ 2
S + 2H = S2− + 2H+
O3 + H2S(газ) = SO2 + H2O
3O+2H(+)+S(-2)=S(+4)+2O(-2)
Восстановление:O3 + 6H+ + 6e− = 3H2O 6 6 1
Окисление: S2− + 2H2O − 6e− = SO2 + 4H+ 6 1
O3 + 2H+ + S2− = H2O + SO2
2SO2+O2=2SO3
2S(+4)+4O(-2)+2O=2S(+6)+6О(-2)
Восстановление: O + 2e− = O2− 2 2 1
Окисление: S4+ − 2e− = S6+ 2 1
O + S4+ = O2− + S6+
SO3 + H2O(хол.) = H2SO4(разб.)
S(+6)+3O(-2)+H2O=2H(+)+ SO4(-2)
CuO + H2SO4 = CuSO4 + H2O
Cu(+2)+O(-2)+2H(+)+SO4(02)=Cu(+2)+SO4(-2)
CuSO4+BaCl2=CuCl2+BaSO4(осадок)
Cu(+2)+SO4(-2)+Ba(+2)+2Cl(-)=Cu(+2)+2Cl(-)+BaSO4
Сила кислоты определяется ее отделять протоны. В HF существуют водородные связи, что образования димеров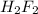 , поэтому протоны отсоединяются плохо и HF слабая кислота. Вода, насколько мы знаем вообще кислота такая себе, в том смысле, что она, конечно отделять протоны (это называется автопротолиз воды), но
, поэтому протоны отсоединяются плохо и HF слабая кислота. Вода, насколько мы знаем вообще кислота такая себе, в том смысле, что она, конечно отделять протоны (это называется автопротолиз воды), но 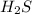 кислота более сильная. Аммиак же еще худшая кислота, чем вода, вернее сказать, он вообще является основанием: у молекулы аммиака есть неподеленная пара электронов, которую она при желании может поместить на пустую орбиталь протона, что и характеризует ее как молекулу основания.
кислота более сильная. Аммиак же еще худшая кислота, чем вода, вернее сказать, он вообще является основанием: у молекулы аммиака есть неподеленная пара электронов, которую она при желании может поместить на пустую орбиталь протона, что и характеризует ее как молекулу основания.
Верными являются варианты 2 и 4. HI, как ни странно, одна из самых сильных кислот. Она сильнее кислоты HBr, потому что сила межяжерного притяжения протона и йода меньше, чем протона и брома (бром более электроотрицателен), следовательно в HI протон уходит лучше, значит и кислота сильнее. 4 вариант вы отметили абсолютно верно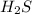 является слабой кислотой даже при диссоциации по первой ступени.
является слабой кислотой даже при диссоциации по первой ступени.