С. буду . 1. какая массa серной кислоты может прореагировать с 3,2 г гидроксида натрия? 2. какая масса натриевой селитры разложилась, если при этом выделилось 6,02⋅1022 молекул кислорода. производя промежуточные расчёты, оставляй 3 цифры после запятой, а ответ пиши с точностью до 2-х знаков после запятой.
1 ответ хз 2 ответ 28
1. 2NaOH+H2SO4 → 2H2O+Na2SO4
Находим количество вещества (NaOH)=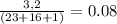 моль
моль
по ур.реакции: 2моль (NaOH) =1 моль (H2SO4)
по усл. задачи: 0.08 моль= 0.08*1/2=0.04
m(H2SO4)= 0.04*(2+32+64)=3.92 г
ответ 3.92г
2. Напомню, что натриевая селитра- NaNO₃
Разложение NaNO3: 2NaNo3 →2NaNo2+O2
N(O2)= 6.02*10^22 ⇒ n(O2)=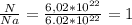 моль
моль
n(NaNO3)= 2n(o2)(из первой задачи) ,⇒ m(NaNO3)= 2моль* 85г/моль= 170г