ГОРЮЧИЕ ГАЗЫ Состав Природные газы заполняют пустоты, образующиеся в горных породах под землёй. 1) Природный газ – смесь разнообразных алканов с небольшой молекулярной массой. Главный компонент – СН4 (объёмная доля – 80-90%, до 98%). Содержатся также С2Н6, С3Н8, С4Н10, С5Н12 (2-3%). Обязательные компоненты – N2, CO2, H2S, пары воды, инертные газы. Дешевое топливо с высокой теплотворной кДж/м3) для бытовых и промышленных нужд; ценное сырье для химической промышленности. При переработке природных газов получают более активные непредельные углеводороды, из которых получают синтетические полимеры, а окислением – спирты, органические кислоты и др. 2) Попутные = нефтяные газы. Растворены в нефти. Отделяются при её добыче. Преобладающий компонент – CH4. Этана, пропана и бутана, а также высших углеводородов намного больше, чем в природных газах. Раньше попутные газы сжигали факельным при их выделении, сейчас – улавливают и используют как сырьё для химической промышленности и в качестве топлива. Попутные газы и газы крекинга нефти перегоняют при низких температурах в индивидуальные углеводороды. При дегидрировании попутных газов получают пропен, бутены и бутадиен, используемые для производства синтетических каучуков. 3) Газы нефтепереработки. Выделяются при переработке нефти. Это смесь углеводородов, главным образом, C3H8, C4H10 и C2H6. Метан содержится в небольших количествах. 4) Коксовый газ. Выделяется при переработке каменного угля коксованием – нагреванием до 1000-1200оС без доступа воздуха. Образуются кокс и каменноугольная смола – источник аренов (бензол, толуол, ксилол, нафталин, фенолы, азотсодержащие соединения) , пек – изготовление электродов, кровельного толя; коксовый газ – обогревание коксовых печей (теплотворная кДж/м3), выделение водорода путем химической переработки. Содержит H2 (60%), CO (3%), CO2 (2%), CH4 (25%), C2H4 (2%), N2 (4%) и другие непредельные и ароматические углеводороды (2%). 5) Продукты газификации каменного угля – взаимодействия его при высоких температурах с различными окислителями (воздухом, водяным паром, CO2). Образуются различные газообразные смеси, содержащие, кроме неорганических компонентов, CH4 и другие углеводороды. Метод всё шире используется в настоящее время в связи с сокращением запасов нефти.
НЕФТЬ Физические свойства Маслянистая жидкость. Цвет – от светло-коричневого до тёмно-коричневого, почти черного (в зависимости от месторождения) . Характерный запах. Плотность – 0,80-0,95 г/см3. В воде практически не растворяется.
Состав Нефть – сложная смесь углеводородов с различной молекулярной массой, в основном – жидких, в которых растворены газообразные и твердые углеводороды. Алканы (парафины) Циклоалканы (нафтены) Ароматические углеводороды. (Соотношение этих соединений различно в нефтях разных месторождений. ) Примеси (массовая доля до 4-5%): oорганические кислоты, oH2S, oсероорганические соединения, oазотсодержащие органические соединения; oв небольших количествах – соединения металлов (Ni, Ca, Mg, V, Fe). Всего в состав нефти входит свыше 20 химических элементов. Добываемая сырая нефть содержит много воды. После её отделения получают товарную нефть, идущую на переработку. Сырая нефть не применяется.
Начнем - с.
Гидролиз пойдет по аниону -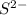
1 - ступень:
Молекулярный Вид: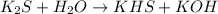
2 - ступень:
Молекулярный вид: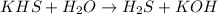
гидролиз пойдет по катиону -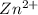
1 - ступень:
МВ: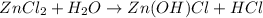
2 - ступень:
МВ: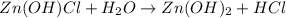
1 - ступень:
МВ: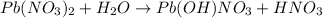
2 - ступень:
МВ: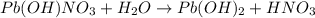
1 - ступень:
МВ: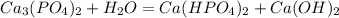
2 - ступень:
МВ: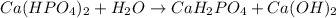
3 - ступень:
МВ: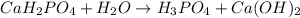 среда щелочная, лакмус синий
среда щелочная, лакмус синий
МВ: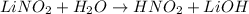
1 - ступень:
МВ: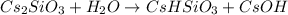
2 ступень:
МВ: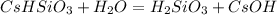
1 - ступень:
МВ: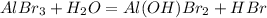
2 - ступень:
МВ: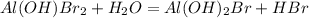
3 - ступень
МВ: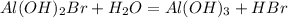
ГОРЮЧИЕ ГАЗЫ
Состав
Природные газы заполняют пустоты, образующиеся в горных породах под землёй.
1) Природный газ – смесь разнообразных алканов с небольшой молекулярной массой. Главный компонент – СН4 (объёмная доля – 80-90%, до 98%). Содержатся также С2Н6, С3Н8, С4Н10, С5Н12 (2-3%). Обязательные компоненты – N2, CO2, H2S, пары воды, инертные газы. Дешевое топливо с высокой теплотворной кДж/м3) для бытовых и промышленных нужд; ценное сырье для химической промышленности.
При переработке природных газов получают более активные непредельные углеводороды, из которых получают синтетические полимеры, а окислением – спирты, органические кислоты и др.
2) Попутные = нефтяные газы. Растворены в нефти. Отделяются при её добыче. Преобладающий компонент – CH4. Этана, пропана и бутана, а также высших углеводородов намного больше, чем в природных газах. Раньше попутные газы сжигали факельным при их выделении, сейчас – улавливают и используют как сырьё для химической промышленности и в качестве топлива. Попутные газы и газы крекинга нефти перегоняют при низких температурах в индивидуальные углеводороды.
При дегидрировании попутных газов получают пропен, бутены и бутадиен, используемые для производства синтетических каучуков.
3) Газы нефтепереработки. Выделяются при переработке нефти. Это смесь углеводородов, главным образом, C3H8, C4H10 и C2H6. Метан содержится в небольших количествах.
4) Коксовый газ. Выделяется при переработке каменного угля коксованием – нагреванием до 1000-1200оС без доступа воздуха. Образуются кокс и каменноугольная смола – источник аренов (бензол, толуол, ксилол, нафталин, фенолы, азотсодержащие соединения) , пек – изготовление электродов, кровельного толя; коксовый газ – обогревание коксовых печей (теплотворная кДж/м3), выделение водорода путем химической переработки.
Содержит H2 (60%), CO (3%), CO2 (2%), CH4 (25%), C2H4 (2%), N2 (4%) и другие непредельные и ароматические углеводороды (2%).
5) Продукты газификации каменного угля – взаимодействия его при высоких температурах с различными окислителями (воздухом, водяным паром, CO2). Образуются различные газообразные смеси, содержащие, кроме неорганических компонентов, CH4 и другие углеводороды. Метод всё шире используется в настоящее время в связи с сокращением запасов нефти.
НЕФТЬ
Физические свойства
Маслянистая жидкость.
Цвет – от светло-коричневого до тёмно-коричневого, почти черного (в зависимости от месторождения) . Характерный запах.
Плотность – 0,80-0,95 г/см3.
В воде практически не растворяется.
Состав
Нефть – сложная смесь углеводородов с различной молекулярной массой, в основном – жидких, в которых растворены газообразные и твердые углеводороды.
Алканы (парафины)
Циклоалканы (нафтены)
Ароматические углеводороды.
(Соотношение этих соединений различно в нефтях разных месторождений. )
Примеси (массовая доля до 4-5%):
oорганические кислоты,
oH2S,
oсероорганические соединения,
oазотсодержащие органические соединения;
oв небольших количествах – соединения металлов (Ni, Ca, Mg, V, Fe).
Всего в состав нефти входит свыше 20 химических элементов.
Добываемая сырая нефть содержит много воды. После её отделения получают товарную нефть, идущую на переработку. Сырая нефть не применяется.