Так, тут потруднее будет... Давай разбираться!) Мы её решим:) И так, у нас с тобой есть раствор NaOH и кусок металла (Na). Первое что мы делаем по условию, это кидаем натрия в данный раствор и наблюдаем бурную реакцию. Дело в том, что ключевое слово в данной задачи - это раствор, а раствор = растворитель (в данном случае вода) + растворённое вещество (NaOH). Так вот, ясно, понятно, что натрий реагировать с NaOH не будет, поскольку основный металл + щелочь = реакция не идёт. Значит, натрий прореагирует с водой, с образованием той же щёлочи NaOH, а значит масса растворённого вщества будет больше, т.е образуется определённая масса NaOH, которая в сумме с уже растворённым веществом даёт новую массу. Либо, новое количество вещества. Так вот!))) Смотри:
4) n(CO2) = V(CO2) : Vm = 11,2 л. : 22,4 л/моль = 0,5 моль;
5) n(NaOH) : n(CO2) = 2,5 : 0,5 = 5 : 1 => n(NaOH) - в избытке, а значит образуется средняя соль - Na2CO3 (Карбонат Натрия). Таким образом, расчёты ведём по недостатку, т.е по n(CO2):
Привет!) У тебя опечточка в задачку ---> там не 112,5г, а 112,5 мл., иначе бы плотность не давали;) Давай решать!)
Дано:
Vр-ра(NaOH) = 112,5 мл.
W(NaOH) = 25% = 0,25
p(NaOH) = 1,28 г/мл
m(AlCl3) = 26,7г.
Найти:
m(Al(OH)3) - ?
1) n(NaOH) = mч.в(NaOH) : M(NaOH) = Vр-ра(NaOH) * W(NaOH) * p(NaOH) / M(NaOH) = (112,5 мл. * 0,25 * 1,28 г/мл) : 40 г/моль = 0,9 моль;
2) n(AlCl3) = m(AlCl3) / M(AlCl3) = 26,7 г : 133,5 г/моль = 0,2 моль;
3) n(NaOH) : n(AlCl3) = 3:1 => n(NaOH) = 3n(AlCl3) = 0,6 моль => n(NaOH) - избыток. Таким образом, решаем по недостатку:
4) n(AlCl3):n(Al(OH)3) = 1:1 => n(Al(OH)3) = n(AlCl3) = 0,2 моль.
5) m(Al(OH)3) = n(Al(OH)3) * M(Al(OH)3) = 0,2 моль * 78 г/моль = 15,6 г.
ответ: m(Al(OH)3) = 15,6 г.
Незачто ;)
Так, тут потруднее будет... Давай разбираться!) Мы её решим:) И так, у нас с тобой есть раствор NaOH и кусок металла (Na). Первое что мы делаем по условию, это кидаем натрия в данный раствор и наблюдаем бурную реакцию. Дело в том, что ключевое слово в данной задачи - это раствор, а раствор = растворитель (в данном случае вода) + растворённое вещество (NaOH). Так вот, ясно, понятно, что натрий реагировать с NaOH не будет, поскольку основный металл + щелочь = реакция не идёт. Значит, натрий прореагирует с водой, с образованием той же щёлочи NaOH, а значит масса растворённого вщества будет больше, т.е образуется определённая масса NaOH, которая в сумме с уже растворённым веществом даёт новую массу. Либо, новое количество вещества. Так вот!))) Смотри:
Дано:
mр-ра(NAOH) = 200 г.
W(NaOH) = 10% = 0,1
m(Na) = 46 г.
V(CO2) = 11,2 л.
Найти:
W%(Na2CO3) - ?
(1)
1) n1(NaOH) = n(Na) = (Na) : M(Na) = 46 г : 23 г/моль = 2 моль;
2) n2(NaOH) = (mр-ра(NaOH) * W(NaOH)) : M(NaOH) = 200 г. * 0,1 : 40 г/моль = 0,5 моль;
3) n3(NaOH) = n1(NaOH) + n2(NaOH) = 2 моль + 0,5 моль = 2,5 моль;
4) n(CO2) = V(CO2) : Vm = 11,2 л. : 22,4 л/моль = 0,5 моль;
5) n(NaOH) : n(CO2) = 2,5 : 0,5 = 5 : 1 => n(NaOH) - в избытке, а значит образуется средняя соль - Na2CO3 (Карбонат Натрия). Таким образом, расчёты ведём по недостатку, т.е по n(CO2):
(2)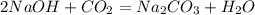
n(Na2CO3) = n(CO2) = 0,5 моль;
m(Na2CO3) = n(Na2CO3) * M(Na2CO3) = 0,5 моль * 106 г/моль = 53 г.
6) mр-ра = mр-ра(NaOH) + m(Na) - m(H2) + m(CO2) = 200 г + 46 г - 2 г + 22 г = 266 г.;
7) W%(Na2CO3) = m(Na2CO3) : mр-ра * 100% = 53 г. : 266 г. * 100% = 20%.
ответ: W%(Na2CO3) = 20%.