Смешали растворы сульфата лития (Li,SO,) 150г 15%-ного и 250г 25%-ного. Вычисли процентную концентрацию растворенного вещества. 1. Масса Li,SO, в 150г 15%-ном растворе: 2. Масса Li, SО, в 250г 25%-ном растворе: 3. Масса соли в растворе после смешивания: 4. Масса раСтвора после смешивания: 5. Процентная концентрация конечного раствора: Ш3 (растворлемое сещество
Дано: m(Zn) = 50 г m(Ag) = 50 г ω(H2SO4)=30%=0.3 m(p-pa H2SO4)-?
Серебро будет реагировать только лишь в концентрированной серной кислоте. Концентрированным считают раствор серной кислоты с массовой долей выше 0,4 или 40%, а у нас по условию задачи - 30%. или 0,3. M(Zn)=65 г/моль n(Zn) = m(Zn)/M(Zn)=50 г/65 г/моль= 0,7692 моль
Zn +H2SO4 = ZnSO4 + H2↑ Из стехиометрических коэффициентов уравнения реакции следует, что n(H2SO4) = n(Zn) = 0,7692 моль m(H2SO4) = n(H2SO4)*M(H2SO4)=0,7692 моль*98 г/моль = 75,3816 г m(p-pa H2SO4) = m(H2SO4)/ω(H2SO4)=75.3816 г/0,3 = 251,3 г ответ: 251,3 г
1.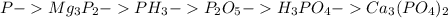
1)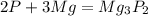
2)
3)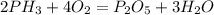
4)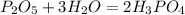
5)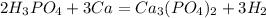
2.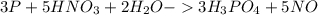
окисление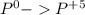 (-5e) восстановитель |5|3
(-5e) восстановитель |5|3
восстановление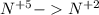 (+3e) окислитель |3|5
(+3e) окислитель |3|5
3. Дано:
m(P)=31кг
________________________________
m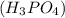 =?
=?
0,2 x
3кмоль 3кмоль
mчист.(P)=31кг*0,2=6,2кг
n(P)=6,2кг/31кг/кмоль=0,2кмоль
m(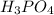 )=0,2кмоль*98кг/кмоль=19,6кг
)=0,2кмоль*98кг/кмоль=19,6кг
m(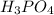 )=19,6кг*08=15,68 кг
)=19,6кг*08=15,68 кг
ответ: 15,68кг
m(Zn) = 50 г
m(Ag) = 50 г
ω(H2SO4)=30%=0.3
m(p-pa H2SO4)-?
Серебро будет реагировать только лишь в концентрированной серной кислоте. Концентрированным считают раствор серной кислоты с массовой долей выше 0,4 или 40%, а у нас по условию задачи - 30%.
или 0,3.
M(Zn)=65 г/моль
n(Zn) = m(Zn)/M(Zn)=50 г/65 г/моль= 0,7692 моль
Zn +H2SO4 = ZnSO4 + H2↑
Из стехиометрических коэффициентов уравнения реакции следует, что n(H2SO4) = n(Zn) = 0,7692 моль
m(H2SO4) = n(H2SO4)*M(H2SO4)=0,7692 моль*98 г/моль = 75,3816 г
m(p-pa H2SO4) = m(H2SO4)/ω(H2SO4)=75.3816 г/0,3 = 251,3 г
ответ: 251,3 г