Так, нам известно, что в ходе данной реакции выделилось 890 кДж теплоты, т.е Q1= 890 кДж; Значит, реакция экзотермическая.
По уравнению реакции, найдём при каком объёме метана выделилось Q1:
Ведём рассчёты только по уравнению! Видно, что вступило в реакцию 1 моль ,т.е n() = 1 моль, значит объём прореагировавшего метана равен: V() = Vm * n() = 22,4 л/моль * 1 моль = 22,4 л.
Теперь нам известно, что при сгорании 22,4 л метана образовалось 890 кДж. А при сгорании 112 л метана количество теплоты неизвестно! Составим пропорцию:
22,4 л - 890кДЖ
112 л - x кДЖ => xкДж= 112 л * 890кДЖ/22,4 л= 4450 => при сгорании 112 л метана образовалось 4450 кДж теплоты, т.е Q2= 4450 кДж.
И проверь все рассчёты, а вдруг Не забудь тыкнуть на
Дано:
mр-ра(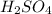 )=200г
)=200г
W(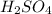 )=4,9%
)=4,9%
Найти:
m(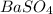 )- ?
)- ?
n(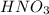 )- ?
)- ?
Поскольку соль бария нерастворима, она и является осадком в данной реакции.
1) mчист.в-ва(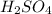 )=m-ра(
)=m-ра(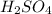 ) * W(
) * W(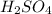 )/100%=200г * 0,049=9,8г.;
)/100%=200г * 0,049=9,8г.;
2) n(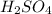 )=mчист.в-ва(
)=mчист.в-ва(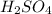 )/M (
)/M (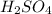 )=9,8г / 98 г/моль=0,1 моль.;
)=9,8г / 98 г/моль=0,1 моль.;
3) По уравнению реакции: n(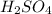 )=n(
)=n(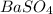 )=0,1 моль.;
)=0,1 моль.;
4) m(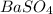 )=n(
)=n(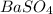 )*M(
)*M(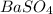 )=0,1 моль * 233 г/моль=23,3 г.;
)=0,1 моль * 233 г/моль=23,3 г.;
5) По уравнению реакции: n(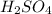 )=2n(
)=2n(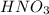 )=0,1 моль * 2=0,2 моль.;
)=0,1 моль * 2=0,2 моль.;
ответ: m(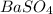 )=23,3 г.; n(
)=23,3 г.; n(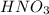 )=0,2моль.
)=0,2моль.
-------------------------------------------------------------------------------------------------
Есть вопросы? Задавай Тык
CH4 (г.) +2O2 (г.) =CO2 (г.) +2H2O (г.) +890 кДж
Так, нам известно, что в ходе данной реакции выделилось 890 кДж теплоты, т.е Q1= 890 кДж; Значит, реакция экзотермическая.
По уравнению реакции, найдём при каком объёме метана выделилось Q1:
Ведём рассчёты только по уравнению! Видно, что вступило в реакцию 1 моль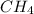 ,т.е n(
,т.е n(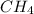 ) = 1 моль, значит объём прореагировавшего метана равен: V(
) = 1 моль, значит объём прореагировавшего метана равен: V(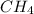 ) = Vm * n(
) = Vm * n(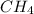 ) = 22,4 л/моль * 1 моль = 22,4 л.
) = 22,4 л/моль * 1 моль = 22,4 л.
Теперь нам известно, что при сгорании 22,4 л метана образовалось 890 кДж. А при сгорании 112 л метана количество теплоты неизвестно! Составим пропорцию:
22,4 л - 890кДЖ
112 л - x кДЖ => xкДж= 112 л * 890кДЖ/22,4 л= 4450 => при сгорании 112 л метана образовалось 4450 кДж теплоты, т.е Q2= 4450 кДж.
И проверь все рассчёты, а вдруг Не забудь тыкнуть на