Тест на тему: « Обратимость химических реакций.»
1 Вариант.
Инструкция: выберите один вариант ответа.
1) Химические реакции, протекающие в противоположных направлениях, называют…
а) кинетическими в) обратимыми
б) термохимическими г) каталитическими
2) В химической литературе иногда встречается утверждение: «
лишь частично превращаются в продукты реакции
б) реакция обратима
в) исходные вещества химическая реакция не всегда доходит до конца» ; оно означает, что…
а) исходные вещества полностью израсходовали внутреннюю энергию
г) продукты реакции начинают оказывать ингибирующее действие
3) Состояние химического равновесия количественно характеризуют…
а) исходными концентрациями реагентов
б) константой Больцмана
в) константой равновесия
г) энергией активации
4)Численное значение константы равновесия химической реакции определяет…
а) скорость реакции в) выход реакции
б) энергию активации г) молекулярность реакции
5) Какое из перечисленных веществ обратимо реагирует с кислородом?
а) оксид серы (Ⅳ) в) цезий
б) фосфор г) оксид азота(Ⅱ )
6) Какая из реакций является обратимой?
а) SO2 + H2O=H2SO3 в) CaO + H2O=Ca(OH)2
б) SO3 + H2O=H2SO4 г) BaO + H2O=Ba(OH)2
7) Как изменяется константа равновесия при повышении температуры?
а) уменьшается б) увеличивается для эндотермических реакций и уменьшается для экзотермических
в) увеличивается г) сначала увеличивается, а затем уменьшается
8) Принцип подвижного равновесия справедлив…
а) только для химических процессов
б) только для физических процессов
в) только для химических процессов с участием катализатора
г) как для химических, так и для физических процессов
9) Изменения, происходящие в обратимой химической системе,
определяются принципом подвижного равновесия, называемым по
имени
а) Гейзенберга в) Ле Шателье
б) Паули г) Марковникова
10) Реакция, в которой повышение давления вызовет смещение
равновесия вправо, - это
а) CH4(г.) + H2O(ж.) ⇄ CO(г.) + 3H2(г.)
б) N2(г.) + O2(г.) ⇄ 2NO(г.)
в) CS2 (г.)+ 2H2S (г.)⇄ CH4(г.) + 4S(тв.)
г) 2NF3(г.) + 3H2 (г.) ⇄ 6HF (г.)+ N2(г.)
11) Химическое равновесие в системе N2(г.) + O2(г.) ⇄ 2NO(г.) – Q
смещается в сторону продукта реакции при
а) повышении давления в) понижении давления
б) повышении температуры г) использовании катализатора
12) В состоянии химического равновесия
а) скорость прямой и обратимой реакции равна нулю
б) концентрация исходных веществ равна концентрации продуктов
реакции
в) скорость прямой равна скорости обратной реакции
г) число молекул исходных веществ равно числу молекул продуктов
реакции
Тест на тему: «Скорость химической реакции. Энергия активации. »
Вариант 1.
Инструкция: выберите один вариант ответа.
1) Для увеличения скорости выделения углекислого газа при действии соляной кислоты на мрамор нужно:
а) разбавить кислоту в) добавить ингибитор
б) измельчить мрамор г) проводить реакцию в атмосфере интертного газа
2) С наибольшей скоростью с кислородом реагирует
а) водород в) уголь
б) фосфор г) этанол
3) Оцените справедливость суждений о скорости химических реакций.
А. При нагревании скорость одних реакций увеличивается, а скорость других – уменьшается.
Б. Причиной увеличения скорости реакции при нагревании является увеличение частоты столкновений частиц.
а) верно только А в) верны оба суждения
б) верно только Б г) Оба суждения неверны
4) Скорость реакции CuO с HCl повысится при
а) разбавлении HCl водой
б) охлаждении
в) изменчивости оксида меди (2)
г) понижении концентрации продуктов реакции
5) Скорость реакции NH3 с O2 повысится при
а) нагревании б) уменьшении концентрации продукта реакции
в) замене кислорода воздухом г) уменьшении концентрации NH3
6)С наибольшей скоростью при обычных условиях взаимодействуют
а) азот и водород в) раствор гидроксида натрия и соляная кислота
б) магний и вода г) сера и железо
7) Давление влияет на скорость реакции между
а) гидроксидом цинка и азотной кислотой б) цинком и серной кислотой
в) аммиаком и кислородом г) серой и алюминием
8) скорость реакции S + O2 = SO2 + Q повысится при
а) измельчении серы в) замене кислорода воздухом
б) охлаждении г) уменьшении концентрации SO2
9) Реакция, скорость которой зависит от площади поверхности соприкосновения реагирующих веществ, - это
а) нейтрализация серной кислоты раствором гидроксида натрия
б) горение водорода в кислороде
в) взаимодействие растворов хлорида меди (2) и гидроксида калия
г) горение алюминия в кислороде
10) скорость реакции 2SO2+O2=2SO3+Q понизится при
а) введении катализатора
б) повышении концентрации кислорода
в) охлаждении
г) повышении концентрации продуктов реакции
11) Реакцию, уравнение которой FeO + 2H+ =Fe2++H2O + Q, можно ускорить ,если
а) повысить давление в) повысить температуру
б) понизить давление г) понизить температуру
Биологические жидкости ( кровь, плазма, лимфа, спиномозговая жидкость) представляют собой коллоидные системы, содержащие такие органические соединения, как белки, холестерин, гликоген, и многие другие, находятся в коллоидном состоянии. Коллоидные системы подразделяют на золи (коллоидные растворы) и гели (студни).
Большинство биологических жидкостей ( цитоплазма, кариоплазма, содержимое вакуолей) и живого организма в целом ( плазма крови, лимфа, тканевая жидкость, пищеварительные соки, гуморальные жидкости и.т.д ) являются коллоидными растворами.
Для золей характерно явление коагуляции, т.е. слипания коллоидных частиц и выпадения их в осадок. При этом коллоидный раствор превращается в суспензию или гель. Некоторые органические коллоиды коагулируют при нагревании ( яичный белок, клей) или при изменении кислотности среды (пищеварительные соки).
Среда раствора - есть те ионы, которые образовались при гидролизе. Т.е. если при гидролизе у нас образовались катионы водорода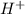 - то среда кислая, если образовались гидроксид - анионы
- то среда кислая, если образовались гидроксид - анионы 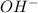 - то среда щелочная.
- то среда щелочная.
Теперь определимся, когда у нас образуются катионы водорода, т.е. кислая среда, а когда гидроксид - анионы, т.е. щелочная среда.
Когда речь идет о гидролизе соли слабого основания и сильной кислоты, то среда будет кислой. Что значит соль сильной кислоты и слабого основания? И так непонятно, так еще и слабые с сильными нарисовались?) Объясняю:
Соль слабого основания - т.е. соль в которой металл взят от нерастворимого основания, например -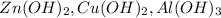 , а сильной кислоты - значит кислотный остаток соли мы украли у сильной кислоты например -
, а сильной кислоты - значит кислотный остаток соли мы украли у сильной кислоты например - 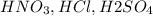 .
.
Пример гидролиза такой соли. Возьмем хлорид меди (II) - который есть в задании:
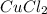 - медь, ее гидроксид в воде нерастворим, значит соль слабого основания, хлор - хлороводородная кислота - сильная, значит соль сильной кислоты и слабого основания, гидролиз идет по слабому - т.е. по катиону меди.
- медь, ее гидроксид в воде нерастворим, значит соль слабого основания, хлор - хлороводородная кислота - сильная, значит соль сильной кислоты и слабого основания, гидролиз идет по слабому - т.е. по катиону меди.
1ст.
Я далее писать уравнение гидролиза не буду, если возникнет желание разобраться, пишите в ЛС
Вернемся к заданию - такую же реакцию среды - кислую имеет хлорид аммония - слабое основание и сильная кислота.
Нитрат калия - это экзотика - среда нейтральная.
Остается один вариант -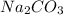 - это как раз то, что мы ищем.
- это как раз то, что мы ищем.
Катион натрия - взят от гидроксида натрия - сильного основания - знаяит соль сильного основания, карбонат - анион - всзят от слабой угольной кислоты, значит среда раствора - щелочная, так как соль сильного основания и слабой кислоты
P.S. Если возникнет желание продолить уравнение гидрорлиза, но не получается, пиши в ЛС