Тест по теме: "Галогены" Выберите правильный вариант ответа
1. К какой подгруппе периодической системы Менделеева относятся галогены:
1.седьмой
2. восьмой
3. шестой
2. Какой галоген не встречается в природе:
1 астат
2 бром
3 хлор
3. Из скольких атомов в обычных условиях состоят галогены:
1 из двух
2 из десяти
3 из девяти
4. Какой цвет имеет фтор:
1.светло – зеленый
2.фиолетовый
3.желто – зеленый
5. Характеристика цвета брома:
1. красно – бурый
2. темно – фиолетовый
3. коричневый
6. Возгонкой называют:
переход веществ при нагревании из твердого состояния в газообразное без жидкостного состояния
2. переход веществ при высокой температуре из газообразного в твердое состояние
3. переход веществ при охлаждении из жидкого в газообразное состояние
7. Температурой кипения йода является:
1.185.5 С
2. 231.8 С
3. 512.6 С
8. Какая существует зависимость при растворимости:
1 уменьшается от хлора к йоду
2 увеличивается от йода к хлору
3 уменьшается от йода к хлору
9. Сколько электронов имеют атомы галогенов на внешнем энергетическом уровне:
1 семь
2 восемь
3 четыре
тест 10. Какие свойства проявляют галогены:
1 как окислительные, так и восстановительные
2 только окислительные
3 только восстановительные
11. Самым сильным окислителем можно назвать:
1 фтор
2 хлор
3 йод
12. С водородом галогены образуют:
1 кислоты
2 основания
3 металлы
13. В чем состоит различие всех галогенов:
1 имеют разный радиус
2 имеют разное количество электронов на внешнем энергетическом уровне
3 все находятся в разных подгруппах периодической системы
14. Хлор входит в соединение:
1 карналлита
2 известняка
3 кремниевого песка
15. В промышленности получения хлора является:
1 электролиз
2 окисление водород содержащего соединения
3 восстановление органической кислоты
16. В лаборатории хлор получают:
1 нагреванием соляной кислоты с перманганатом калия
2 соединением хлорида натрия с углеродом
3 охлаждением хлорида серебра при температуре минус пятьдесят градусов
17. Раствор хлора в воде именуют:
1 хлорной водой
2 гашеной известью
3 бертолетовой солью
18. Условие, при которой происходит взаимодействие хлора с водородом:
1 высокая температура или свет
2 платинум или бериллий
3 охлаждение
19. Хлор не взаимодействует:
1 с благородными газами
2 с металлами
3 с неметаллами
20. Продуктами разложения хлорной воды являются:
1 соляная кислота и атомарный кислород
2 вода и хлор
3 водород и хлороводородная кислота
21. Областью применения хлора является:
1 для обеззараживания питьевой воды
2 для изготовления машинного масла
3 для производства парфюмерии
22. В лаборатории хлороводород получают:
1 реакцией концентрированной серной кислоты с твердым хлоридом натрия
2 взаимодействием хлорной воды с кислородом
3 реакцией замещения хлорида калия на атомарный водород
23. Хлороводород является:
1 бесцветным газом
2 маслянистой жидкостью
3 твердым веществом
24. Раствор хлороводорода в воде – это:
1 хлороводородная кислота
2 йодоводородная кислота
3 ортофосфорная кислота
25. Качественной реакцией на соляную кислоту является:
1 нитрат серебра
2 карбонат кальция
3 сульфат железа
26. Что образуется при взаимодействии соляной кислоты с атомом серебра:
1 белый творожистый осадок
2 фиолетовый газ
3 красно- розовая жидкость
27. Первооткрыватель фтора – это:
1 А. Муассан
2 Ж. Гей – Гарадак
3 Д. И. Менделеев
28. Повышенное содержание фтора в воде ведет к:
1 повышению хрупкости костей
2 образованию язвы желудка и двенадцатиперстной кишки
3 проявлению неврологических расстройтв
29. Фторид кальция входит в состав:
1 зубной эмали
2 слизистой оболочки пищевода
3 гормональных препаратов
30. Какой минимальный уровень фтора должен быть в воде?
1 более 0.00005 %
2 менее 0.00001 %
3 менее 0.00003 %
31. В каком году был открыт фтор:
1 в тысяча восемьсот восемьдесят шестом году
2 в тысяча пятьсот тридцать седьмом году
3 в тысяча триста двадцать пятом году
32. Растворимым соединением является:
1 фторид серебра
2 йодид серебра
3 бромид серебра
33. Фреон изготавливают из:
1 фтора
2 кальция
3 золота
34. Кто открыл бром?
1 А. Балар
2 П. Лайет
3 Д. Никлес
35. Бром является:
1 жидкостью
2 газообразным веществом
3 твердым веществом
36. В состав бромной воды входит:
1 бром
2 аспартат магния
3 ацетат меди
37. Бромид серебра необходим для ихготовления:
1 фотокарточки
2 хлопчатобумажных тканей
3 строительных материалов
38. Характерной реакцией на свободный йод – это:
1 посинение крахмала
2 образование осадка
3 получение желто- оранжевого газа
39. Действием йодной настойки является:
1 кровоостанавливающее действие
2 снижение кислотности желудочного сока
3 симпатомиметическое действие
тест*40. В поваренную соль добавляют:
1 йодид натрия
2 фторид калия
3 бромид серебра
1. На внешнем уровне атомы щелочноземельных металлов имеют три электрона. Неверно. На внешнем уровне атомы щелочноземельных металлов находятся 2 электрона. Конфигурация внешнего уровня атомов щелочноземельных металлов -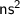 (где
(где  - номер периода, в котором находится элемент, или номер последнего энергетического уровня).
- номер периода, в котором находится элемент, или номер последнего энергетического уровня).
2. Щелочноземельные металлы реагируют с водой с выделением кислорода. Неверно. При взаимодействии щелочноземельных металлов с водой выделятся газ водород -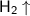 . Схема реакции взаимодействии щелочноземельных металлов с водой -
. Схема реакции взаимодействии щелочноземельных металлов с водой - 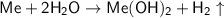 (где
(где  - щелочноземельный металл).
- щелочноземельный металл).
3. Щелочноземельные металлы активно реагируют с водой. Верно.
4. Стронций не может проводить тепло. Неверно. Стронций -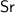 является металлом, а металлы могут проводить тепло.
является металлом, а металлы могут проводить тепло.
ответ : верное утверждение под номером 3.1.
Cu⁺²S⁺⁶O⁻²4
Al⁻³(O⁻²H⁺)3
H⁺S⁺⁶O⁻²4
Fe⁺³2O⁻²3
C⁺⁴O⁻²2
2.
Fe⁺³2(S⁺⁶O⁻²4)3
Mg⁺²(N⁺⁵O⁻²3)2
S⁺⁶O⁻²3
N⁺⁵2O⁻²5
Cr⁺³Cl⁻3
3.
Ca⁺²3(P⁺⁵O⁻²4)2
H⁺2Si⁺⁴O⁻²3
Zn⁺²(O⁻²H⁺)2
Ba⁺²S⁺⁶O⁻²4
4.
Al⁺³2(S⁺⁶O⁻²4)3
Cu⁺²O⁻²
H⁺3P⁺⁵O⁻²4
S⁺⁶O⁻²3
S⁺⁴O⁻²2
Cu⁺²Cl⁻2
Рассмотрим на примере серной кислоты H2SO4.
Нужно запомнить, что степень окисления водорода в кислотах всегда +1, а кислорода -2⇒ можно определить степень окисления серы, составив уравнение электронейтральности:
2·(+1) + 1·x + 4·(-2) = 0, где х - степень окисления серы.
2 + х - 8 = 0;
x - 6 = 0;
x = +6 ⇒ Степень окисления серы +6⇒H⁺2S⁺⁶O⁻²4
Объяснение: