Тест по теме: Периодический закон, периодическая система, строение атома.
I вариант
1 Сущность периодического закона состоит в том, что с ростом заряда ядра
периодически изменяется:
1) общее число электронов
2) атомная масса элемента
3) число энергетических уровней
4) число электронов на внешнем
уровне
2 Какое утверждение является неверным. В группе сверху вниз:
1) увеличивается заряд ядра
2) увеличивается радиус атома
3) увеличивается число электронов на внешнем энергетическом уровне
4) ослабевают неметаллические свойства
3 Летучее водородное соединение элемента имеет формулу H2Э. Укажите формулу
высшего оксида:
1) ЭО
2) ЭО3
3) Э2О
4) ЭО2
4 Укажите атом с наибольшим числом не спаренных электронов:
1) С
2) Р
3) Al
4) Cl
5 Как меняются в ряду C – Si – Ge – Pb неметаллические свойства элементов:
1) возрастают
2) возрастают, а потом ослабевают
3) ослабевают
4) не изменяются
6 В какой группе, подгруппе и периоде находится элемент валентная конфигурация
которого 3d14s2:
1) II группа, побочная подгруппа, 4 период;
2) III группа, главная подгруппа, 3 период;
3) II группа, главная подгруппа, 4 период;
4) III группа, побочная подгруппа, 4 период.
7 Какая электронная формула соответствует атому серы:
1) 1s22s22p63s23p4
2) 1s22s22p4
3) 1s22s22p63s23p6
4) 1s22s22p63s23p5
8 Электронная конфигурация наружного слоя …nS2. Определите характер элемента:
1) неметалл
2) металл
3) определить нельзя
9 Укажите атом, имеющий 5 электронов на внешнем энергетическом уровне и
свободный d-подуровень:
1) P
2) N
3) O
4) S
10 К какому семейству относится Sn:
1) d – элементы
2) s – элементы
3) p –элементы
4) f – элементы
11 У элементов одного периода сходно:
1) число энергетических уровней
2) химические свойства
3) характер оксидов
4) сходства отсутствуют
12 Представьте себе мир, где у атомов на одной орбитали размещается 3 электрона.
Укажите число элементов 2 периода периодической системы в этом мире:
1) 3
2) 6
3) 8
4) 12
1)Б
2)В
3)А - не это не изомер, а это же вещество
4)А - я бы сказал не предыдущим, а последующим гомологом
5)А
6)В
7)А
8)Б
9)В
10)В
11) C₂H₅OH --H₂SO₄--> C₂H₄ + H₂O
C₂H₄ + HCl --> C₂H₅Cl
2C₂H₅Cl + 2Na --> C₄H₁₀ + 2NaCl
12) Формула C₅H₁₀
Межклассовая изомерия
CH₂=CH-CH₂-CH₂-CH₃ пентен-1
CH₃-CH=CH₂-CH₂-CH₃ пентен-2
Измерия углеродной цепи:
CH₂-CH-CH₃ метилциклобутан
| |
CH₂-CH₂
13) арены используются для производства ядов для насекомых и грызунов, их гомологи для производства красок смол , в качестве растворителей, в орг. синтезе
14)
Молярная масса углеводорода: M = D(H₂)*M(H₂) = 14*2=28 г/моль
На 100 г соединения приходится 85,7 г С и 14,3 г Н (в решении опечатка где-то - должно быть не более 100% суммарно).
Соотношение количеств элементов:
n(C) : n(H) =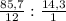 = 7,14 : 14,3 = 1:2
= 7,14 : 14,3 = 1:2
Формула CH₂
А так как молярная масса 28 г/моль, то C₂H₄, т.е. этен
ответ:ω%(Fe)=21%,ω%(Zn)=65%,ω%(Ag)=14%
Объяснение:С серной кислоты реагируют ,цинк и железа :
Zn+H2SO4→ZnSO4+H2 (1)
Fe+H2SO4→ZnSO4+H2 (2)
В составе нерастворившийся остатке будут серебро, а в составе раствора будут ZnSO4,FeSO4. Так как гидроксид цинка является амфтерным,в осадке будет Fe(OH)2
ZnSO4+4KOH→K2[Zn(OH)4]+K2SO4
FeSO4+2KOH→K2SO4+Fe(OH)2
Осадок Fe(OH)2 разлагается при нагревании
Fe(OH)2→ FeO+Н2О,значить 10,8г это масса FeО
ν( FeO)=0,15моль,масса железа 0,15*56=8,4г,по реакции (2) видно,что 0,15моль железо вытесняет из серной кислоты 0,15 моль Н2,а общая количество водорода 12,32/22,4= 0,55,моль,тогда по реакции (1) выделяется 0,55-0,15=0,4 моль Н2 и соответственно количество вещества цинка тоже 0,4 моль,его масса 0,4*65=26 г. Масса серебра в смеси 40-26-8,4=5,6г.ω%(Fe)=8,4*100/40=21%, ω%(Zn)=26*100/40=65%,ω%(Ag)=100-21-65=14%