У двох пробірках знаходяться розчини гліцерину та оцтової кислоти. Доведіть наявність цих речовин. Опишіть фізичні властивості (колір, запах, прозорість). Які хімічні реакції підтверджують це? Складіть рівняння реакцій (якщо можливо). Опишіть ознаки цих реакцій.
P(с.о. 0) - 3е = P(с.о. +3)
Br2 (с.о. 0) +1e х 2 = 2Br (с.о. -1)
НОК - 6, следовательно у фосфора коэффициент получаем 2, а у брома - 3. Тройка в продукте реакции уже есть, значит, нужно поставить только двойку перед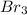 . Затем уравниваем фосфор и бром, и получается:
. Затем уравниваем фосфор и бром, и получается: 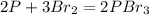 . Восстановителем является фосфор (процесс - окисление), а окислителем - бром (процесс, соответственно, восстановление).
. Восстановителем является фосфор (процесс - окисление), а окислителем - бром (процесс, соответственно, восстановление).
Br2 (с.о. 0) +1e х 2 = 2Br (с.о. -1) - окислитель, восстановление
2I (с.о. -1) - 1e х 2 = I2 (с.о. 0) - восстановитель, окисление
Получается: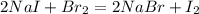
Пояснения к ответом - курсивом
1 Б. 2е, 1е. (У атома лития две электронные оболочки, первая полностью заполнена - 2 s-электронами, в второй - единственный s-электрон, отсюда ₊₃ Li 1s² 2s¹ или, проще, Li 2,1)
2 Б.2. (У всех щелочноземельных металлов во внешней электронной оболочке 2 s-электрона)
4 Г. Индий.
Здесь возможны разные ответы в зависимости от того, что считать металлическими свойствами элемента.
Если судить по электроотрицательности атомов (чем она ниже, тем "металличнее" элемент), то самый металличный - алюминий (1,61), затем индий (1,78), потом галлий (1,81), и наконец, бор (2,04) - самый электроотрицательный и наименее металличный из всех четырех элементов.
Если судить по стандартным электродным потенциалам в водных растворах (то есть по ряду напряжений металлов), то самый металличный - алюминий (Е⁰ = - 1,66 В) - он в ряду левее всех из этого списка, затем галлий (-0,53 В), потом индий (-0,34). Однако для бора такая оценка не подходит, поскольку он неметалл (с другой стороны, именно поэтому его можно и не учитывать - ясно, что неметалл - не лидер по металличности :-) ).
Если судить по химическим свойствам элементов, то самый металличный из перечисленных - индий, поскольку он практически не образует амфотерных соединений. В то время как бор образует кислотные оксид и гидроксид (борная кислота), алюминий - амфотерные оксид и гидроксид, галлий амфотерен почти также, как и алюминий, индий слабо амфотерен, а таллий (здесь не рассматривается) вовсе не проявляет амфотерных свойств.
Я бы лично ответил - А. алюминий, поскольку в вопросе говорится о свойствах простых веществ - элементов, то есть свойствах атомов. Однако в школьном курсе, а судя по степени сложности всех остальных вопросам, это школьный, а не вузовский курс (только непонятно, откуда в школьном курсе галлий и индий), принято говорить, что по группе сверху вниз металлические свойства усиливаются. Поэтому правильный ответ Г. индий (он ниже всех в группе из перечисленных элементов).
3 Г. Металлическая.(у всех металлов металлическая связь)
4. этого пункта нет в самом задании!
5 В. Увеличивается. (По группе с ростом номера радиус атомов увеличивается, по периоду - уменьшается)
6 Б. Числом электронов на внешнем энергетическом уровне. (Атом превращается в ион, отдавая со своего внешнего уровня или принимая на свой внешний уровень электроны. Ядро атома в этом процессе не участвует. Число протонов (оно же заряд ядра) и нейтронов - это как раз свойства ядра).
7 А. Барий. (На самом деле, кальций, а особенно стронций и барий практически одинаково бурно реагируют с водой. А вот магний при комнатной температуре реагирует с водой медленно. Но опять-таки, в школьном курсе чем больше порядковый номер металла в группе, тем он металличнее и активнее)
8 В. Серебро. (Алюминий не растворяется во многих кислотах за счет оксидной пленки, но с соляной кислотой алюминий реагирует)
9 Б. Р₂O₅. (гидроксид натрия, будучи щелочью, реагирует с кислотами и кислотными оксидами, а оксид фосфора P₂O₅ - единственный кислотный оксид в списке, а кислот в нем вовсе нет)
10 Б. Сl₂, СuСl₂, НСl.
(железо реагирует и с хлором, и с хлоридом меди, и с соляной кислотой. Из списка А железо не реагирует с углекислым газом (но реагирует с угарным газом!). Из списка В железо не реагирует с оксидом кальция. Из списка Г - с диоксидом серы - точнее, с сухим диоксидом серы (IV) SO₂. В присутствии паров воды образуются сульфит железа (II) FeSO₃ и тиосульфат железа (II) FeS₂O₃, в присутствии кислорода и воды SO₂ может окислиться до SO₃ и образовать серную кислоту H₂SO₄. Последняя вступит в реакцию с железом)
ЧАСТЬ Б.
11
а) Ca + 2 H₂O = Ca(OH)₂ + H₂↑
б) CaO + H₂O = Ca(OH)₂
в) CaH₂ + 2 H₂O = Ca(OH)₂ + 2 H₂↑
CaH₂ - гидрид кальция - солеообразное соединение с ионной решеткой с катионам кальция Ca²⁺ и анионами в виде гидрид-ионов H⁻
12
Fe → FeCl3 → Fe(OH)3 → Fe2(SO4)3 → Fe(OH)3 → Fe2O3
2 Fe + 3 Cl₂ → 2 FeCl₃ (хлорид железа (III))
FeCl₃ + 3 KOH → Fe(OH)₃ (гидроксид железа (III)) + 3 KCl (хлорид калия)
2 Fe(OH)₃ + 3 H₂SO₄ → Fe₂(SO₄)₃ (сульфат железа (III)) + 6 H₂O (вода)
Fe₂(SO₄)₃ + 6 NaOH → 2 Fe(OH)₃ (гидроксид железа (II)) +
+ 3 Na₂SO₄ (сульфат натрия)
2 Fe(OH)₃ → Fe₂O₃ (оксид желез (III)) + 3 H₂O (вода)
13
а) 4 Li + O₂ → 2 Li₂O (оксид лития)
б) 2 Li + 2 H₂O → 2 LiOH (гидроксид лития) + H₂↑
в) 2 Li + S → Li₂S (сульфид лития)
14
мел углекислый газ
CaCO₃ + HCl = CaCl₂ + H₂O + CO₂↑
100 г 22,4 л
50 г *(100%-3%) х л
х = 50 г*(100-3)%*22,4 л / 100 г = 50 г * 0,97 * 22,4 л / 100 г = 10,9 л
ответ: 10,9 л.
15 Восстановим железо из оксида железа, например, водородом:
Fe₂O₃ + 3 H₂ → 2 Fe + 3 H₂O
160 г 2*56 г
80 г х г
х = 80 г* 2*56 г / 160 г = 56 г.
ответ: 56 г.