Укажите неверное утверждения: 1. Электролиз – ОВР под действием электрического тока. 2. Анод – это один из электродов электролизера 3. Катион в растворе, подвергающегося электролизу, под действием электрического тока перемещается к катоду 4. Катионы металлов при электролизе восстанавливаются на катоде
2При электролизе водного раствора гидроксида натрия на катоде будет образовываться
3. При электролизе водного раствора сульфата никеля на аноде будет образовываться?
4.Укажите, какие ионы будут при электролизе перемещаться к аноду, а какие – к катоду: Fe2+, S2-, Cl-, F-, Ag+, Zn2+, I-
5. Укажите, какие металлы можно получить в виде веществ при электролизе водных растворов их солей: калий, медь, алюминий, золото, серебро, кальций, ртуть, литий.
6. .При электролизе раствора хлорида калия на катоде происходит?
7. Электролиз раствора бромида бария протекает по следующей схеме: *
BaBr2 + H2O = Br2 + Н2 + Ba(OH)2
BaBr2 + H2O= Br2 + Ba + H2O
BaBr2 + H2O = Br2 + О2 + Ba(OH)2
8. Электролиз раствора нитрата серебра протекает по следующей схеме: *
AgNO3 + H2O = Ag + Н2 + HNO3
AgNO3 + H2O = Ag + О2 + HNO3
AgNO3 + H2O = AgNO3 + Н2 + О2
9. Электролиз раствора сульфида натрия протекает по следующей схеме: *
Na2S + H2O = Н2 + O2 + Na2S
Na2S + H2O = S + Н2 + NaOH
Na2S + H2O = Н2 + Na2S + NaOH
СЕГОДНЯ
Получено 19,6 г сульфата хрома (III) Cr₂(SO₄)₃ и 3,36 л водорода
Объяснение:
Дано: m(Cr) = 5,2 г; m(H₂SO₄) = 98 г.
Найти: m(Cr₂(SO₄)₃); V(H₂).
Решение.
2Cr + 3H₂SO₄ → Cr₂(SO₄)₃ + 3H₂
По уравнению реакции хром и серная кислота реагируют в отношении 2 моль : 3 моль. Найдем количество вещества в заданных массах:
Молярная масса M(Cr) = 52 г/моль
Количество вещества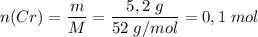 .
.
M(H₂SO₄) = 2 + 32 + 64 = 98 г/моль
На 0,1 моль Cr требуется 0,15 моль H₂SO₄. Серная кислота дана в избытке. Расчет ведем по хрому.
По уравнению реакции
n(Cr) : n(Cr₂(SO₄)₃) : n(H₂) = 2 : 1 : 3 = 0,1 моль : 0,05 моль : 0,15 моль
Найдем массу образовавшегося сульфата хрома (III) Cr₂(SO₄)₃
M(Cr₂(SO₄)₃) = 2*52 + 32*3 + 16*4*3 = 104 + 96 + 192 = 392 г/моль
m(Cr₂(SO₄)₃) = n*M = 0,05 моль * 392 г/моль = 19,6 г.
Найдем объем выделившегося водорода:
V(H₂) = n*Va = 0,15 моль * 22,4 л/моль = 3,36 л.
Решение:
BaCl2 + Na2SO4 -> BaSO4 + 2NaCl
Определим, что находится в избытке, а что в недостатке:
1) 15*0.05 = 0.75 грамм (масса безводного (прореагировавшего) BaCl2)
10*0.08 = 0.8 грамм (Na2SO4) - также
2) n(BaCl2) = 0.75\208 = 0.0036 моль
n(Na2SO4) = 0.8\142 = 0.0056 моль
=> по ур. р-ии. n(BaCl2) = n(Na2SO4) => хлорид бария в недостатке, считаем по нему:
3) n(BaCl2) = n(BaSO4) => n(BaSO4) = 0.0036 моль
4) m(BaSO4) = 233 * 0,0036 = 0.8388 грамм. ответ: 0.8 грамм