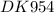Дано:
V(р-ра CaCl₂) = 150 мл
ω(CaCl₂) = 16%
ρ(р-ра CaCl₂) = 1,14 гр/мл
-----------------------------------------
Найти:
m(CaCl₂ · 6H₂O) - ?
m(H₂O необ.) - ?
1) Для начала мы запишем уравнение реакций, именно по такой уравнений мы будем пользоваться:
CaCl₂ + 6H₂O → CaCl₂ · 6H₂O
2) Далее находим массу у хлорида кальция:
m(р-ра CaCl₂) = V(р-ра CaCl₂) × ρ(р-ра CaCl₂) = 150 мл × 1,14 гр/мл = 171 гр
m(CaCl₂) = m(р-ра CaCl₂)×ω(CaCl₂)/100% = 171 гр × 16%/100% = 171 гр × 0,16 = 27,36 гр
3) Теперь находим количества вещества у хлорида кальция, потом воды в кристаллогидрате по уравнению реакций:
M(CaCl₂) = 40 + 35,5×2 = 40 + 71 = 111 гр/моль
n(CaCl₂) = m(CaCl₂)/M(CaCl₂) = 27,36 гр / 111 гр/моль ≈ 0,25 моль ⇒ n(H₂O) = 6n(CaCl₂) = 6×0,25 моль = 1,5 моль
4) Теперь находим массу воды:
M(H₂O) = 1×2 + 16 = 2 + 16 = 18 гр/моль
m(H₂O) = n(H₂O) × M(H₂O) = 1,5 моль × 18 гр/моль = 27 гр
5) Теперь находим массу кристаллогидрата:
m(CaCl₂ · 6H₂O) = m(CaCl₂) + m(H₂O) = 27,36 гр + 27 гр = 54,36 гр
ответ: m(H₂O) = 27 гр
m(CaCl₂ · 6H₂O) = 54,36 гр
Решено от :
Ca3p2 кальций +2, фосфор -3
ClF5 хлор +5, фтор -1
Fe2O3 железа +3, кислород -2
BaOhNo3 барий +2, кислород -2, водород +1, азот +5, кислород -2
K2siO3 калий +1, кремний +4, кислород -2
CdSO4 кадмий +2, сера +6, кислород -2
CaH2 кальций +2, водород -1
AlBr3 алюминий +3, бром -1
SO3 сера +6, кислород -2
CrOhSO3 хром +3, кислород -2, водород +1, сера +4, кислород -2
MgHPO4 магний +2, водород +1, фосфор +5, кислород -2
Ca(OH)2 кальций +2, кислород -2, водород +1
FeCl3 железо +3, хлор -1
AgNo3 серебро +1, азот +5, кислород -2
Дано:
V(р-ра CaCl₂) = 150 мл
ω(CaCl₂) = 16%
ρ(р-ра CaCl₂) = 1,14 гр/мл
-----------------------------------------
Найти:
m(CaCl₂ · 6H₂O) - ?
m(H₂O необ.) - ?
1) Для начала мы запишем уравнение реакций, именно по такой уравнений мы будем пользоваться:
CaCl₂ + 6H₂O → CaCl₂ · 6H₂O
2) Далее находим массу у хлорида кальция:
m(р-ра CaCl₂) = V(р-ра CaCl₂) × ρ(р-ра CaCl₂) = 150 мл × 1,14 гр/мл = 171 гр
m(CaCl₂) = m(р-ра CaCl₂)×ω(CaCl₂)/100% = 171 гр × 16%/100% = 171 гр × 0,16 = 27,36 гр
3) Теперь находим количества вещества у хлорида кальция, потом воды в кристаллогидрате по уравнению реакций:
M(CaCl₂) = 40 + 35,5×2 = 40 + 71 = 111 гр/моль
n(CaCl₂) = m(CaCl₂)/M(CaCl₂) = 27,36 гр / 111 гр/моль ≈ 0,25 моль ⇒ n(H₂O) = 6n(CaCl₂) = 6×0,25 моль = 1,5 моль
4) Теперь находим массу воды:
M(H₂O) = 1×2 + 16 = 2 + 16 = 18 гр/моль
m(H₂O) = n(H₂O) × M(H₂O) = 1,5 моль × 18 гр/моль = 27 гр
5) Теперь находим массу кристаллогидрата:
m(CaCl₂ · 6H₂O) = m(CaCl₂) + m(H₂O) = 27,36 гр + 27 гр = 54,36 гр
ответ: m(H₂O) = 27 гр
m(CaCl₂ · 6H₂O) = 54,36 гр
Решено от :