Здесь у нас довольно необычная ОВР - два сильнейших окислителя - кислород и фтор. Но все - таки, кислород будет восстановителем, ибо фтор ни при каких условия не будет таковым.
Запишем данную реакцию вместе со степенями окисления:
Запишем реакции окисления и восстановления. Окисляться у нас будет кислород, так как степень окисления у него растет от -2 до +2(во фториде ), запишем этот процесс:
- окисление, кислород - восстановитель
Теперь со фтором. Фтор - самый сильный - ПЕРВЫЙ окислитель, у никогда не будет положительной степени окисления. В этой реакции его СО изменяется от 0 до -1. Запишем этот переход:
- восстановление - сам фтор - окислитель
Теперь распишем переходы электронов для каждого процесса:
Для Фтора:
- теперь уравняем фтор, что бы и слева и справа его было по 2:
Для Кислорода:
- здесь все нормально.
Теперь нам надо, чтобы количество оттданых элетронов(т.е. число электронов которые отдал кислород) равнялось количеству принятых электронов(т.е. тех которые принял фтор). Кислород отда - 4 электрона, а фтор принял только - 2, значит уравнение восстановления фтора умножаем на два:
Теперь мы суммируем, т.е. записываем в систему два полученных уравнения с кислородом и со фтором:
- восстановление - окислитель
- окисление - восстановитель.
Та двойка которая получилась перед и та 4 которая получилась перед - это коэффициенты - выносим их в левую часть получим:
- видим, что фтора - 4, а в правой части только три, значит нам надо поставить перед - двойку. Поулчим:
- теперь натрий обделили, в левой части - 1, а в правой - 2, значит нам надо поставить 2 перед , перепишем с получившимися коэффициентами:
Здесь у нас довольно необычная ОВР - два сильнейших окислителя - кислород и фтор. Но все - таки, кислород будет восстановителем, ибо фтор ни при каких условия не будет таковым.
Запишем данную реакцию вместе со степенями окисления:
Запишем реакции окисления и восстановления. Окисляться у нас будет кислород, так как степень окисления у него растет от -2 до +2(во фториде ), запишем этот процесс:
Теперь со фтором. Фтор - самый сильный - ПЕРВЫЙ окислитель, у никогда не будет положительной степени окисления. В этой реакции его СО изменяется от 0 до -1. Запишем этот переход:
Теперь распишем переходы электронов для каждого процесса:
Для Фтора:
Для Кислорода:
Теперь нам надо, чтобы количество оттданых элетронов(т.е. число электронов которые отдал кислород) равнялось количеству принятых электронов(т.е. тех которые принял фтор). Кислород отда - 4 электрона, а фтор принял только - 2, значит уравнение восстановления фтора умножаем на два:
Теперь мы суммируем, т.е. записываем в систему два полученных уравнения с кислородом и со фтором:
Та двойка которая получилась перед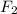 и та 4 которая получилась
и та 4 которая получилась  перед - это коэффициенты - выносим их в левую часть получим:
перед - это коэффициенты - выносим их в левую часть получим:
Понятно???
этан- алкан (между атомами одна связь sp3) Ch3-Ch3
Хим. свойства
горение C2H6+O2=CO2+H2O
реакция замещения по свободному радикалу
c2h6+cl2=c2h5cl+hcl
этилен- алкен (между атомами есть одна двойная связь sp2) ch2=ch2
Хим. свойства
в первую очередь будет разрываться пи связь
реакция горения
C2H4+O2=CO2+H2O
реакция окисления
C2H4+[O,KMnO4,HNO3]=Ch2-O-Ch2 (оксид этилена)
гидрирование
C2H2+H2=C2H6
гaлогенирование
C2H4+[Г2(7группа)]=Г-Ch2-Ch2-Г
гидрогалогенирование
C2h4+HCl= C2H5Cl
гидротация
C2H4+HOH=C2H5Oh
полимиризация