В смесь двух аминов с одинаковой молярной массой (плотность по азоту 1.6) добавили некое количество раствора нитрита калия в соляной кислоте, в котором вся соляная кислота вступила в реакцию. В ходе реакции смеси аминов с этим раствором выделилось 3.36 л газа (при н.у.), а количество вещества одного из аминов, сократившись на 40%, стало равным количеству вещества второго амина в исходной смеси. Какова была масса исходной смеси аминов в граммах?
Надо уметь работать с таблицей Менделеева. Ar - относительная атомная масса (1 атом); Mr - относительная молекулярная масса (2 и более атомов). Допустим, нам надо определить Ar(Zn), Mr(HCl) - ? Берёшь таблицу, находишь цинк, там обязательно будет атомная масса! Т.е, относительная атомная масса 1 элемента Цинк, равна 65; дальше, рассуждаешь: так, HCl - соляная кислота, по качественному составу: в данную молекулу входят H и Cl (Хлор и Водород); по количественному составу (1- хлор и 1-водород (смотришь на индексы)). Значит Mr(HCl) = Ar(H) + Ar(Cl) = 1 + 35,5 = 36,5. Давай решать твою задачу! ) = Mr
) = Mr ;
;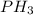 ) > Mr(
) > Mr(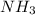 );
);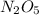 ) < Mr(
) < Mr( ).
).
1) Ar(Na) < Ar(P);
2) Ar(N) < Ar(Cl);
3) Mr(
4) Mr(
5) Ar(Cu) < Ar(Zn);
6) Ar(H) < Ar(O);
7) Mr(1
-------------------------------------------------------------------------------------------------
Есть вопросы? Задавай Если человек знает, чего он хочет, значит, он или много знает, или мало хочет."
Надо уметь работать с таблицей Менделеева. Ar - относительная атомная масса (1 атом); Mr - относительная молекулярная масса (2 и более атомов). Допустим, нам надо определить Ar(Zn), Mr(HCl) - ? Берёшь таблицу, находишь цинк, там обязательно будет атомная масса! Т.е, относительная атомная масса 1 элемента Цинк, равна 65; дальше, рассуждаешь: так, HCl - соляная кислота, по качественному составу: в данную молекулу входят H и Cl (Хлор и Водород); по количественному составу (1- хлор и 1-водород (смотришь на индексы)). Значит Mr(HCl) = Ar(H) + Ar(Cl) = 1 + 35,5 = 36,5. Давай решать твою задачу!
1) Ar(Na) < Ar(P);
2) Ar(N) < Ar(Cl);
3) Mr(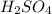 ) = Mr
) = Mr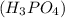 ;
;
4) Mr(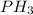 ) > Mr(
) > Mr(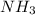 );
);
5) Ar(Cu) < Ar(Zn);
6) Ar(H) < Ar(O);
7) Mr(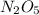 ) < Mr(
) < Mr(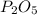 ).
).
-------------------------------------------------------------------------------------------------
Есть вопросы? Задавай Если человек знает, чего он хочет, значит, он или много знает, или мало хочет."