________________________________ Решение: Уравнение реакции: H2C=CH2 + H2O ----> H2C-CH2OH n(C2H4) = = = 3 моль По уравнению реакции количества вещества этилена (n(C2H2)) равно теоретическому количеству вещества этилового спирта или этанола (n теор.(C2H5OH)), т.к. коэффициенты перед формулами соответствующих веществ равны (в данном случае отсутствуют). n теор.(C2H5OH) = n(C2H2) = 3 моль n практич. (С2H5OH) = n теор.(С2H5OH) * η = 3 * 0,6 = 1,8 моль m практич. (C2H5OH) = M(C2H5OH) * n практич. (C2H5OH) = 46 * 1,8 = 82,8 г ответ: m (C2H5OH) = 82,8 г
V(C2H4) = 67,2 л
M(C2H4) = 28 г/моль
η(C2H5OH) = 60%
M(C2H5OH) = 46 г/моль
Vm = 22,4 л/моль
________________________
m(C2H5OH) - ?
________________________________
Решение:
Уравнение реакции:
H2C=CH2 + H2O ----> H2C-CH2OH
n(C2H4) =
По уравнению реакции количества вещества этилена (n(C2H2)) равно теоретическому количеству вещества этилового спирта или этанола (n теор.(C2H5OH)), т.к. коэффициенты перед формулами соответствующих веществ равны (в данном случае отсутствуют).
n теор.(C2H5OH) = n(C2H2) = 3 моль
n практич. (С2H5OH) = n теор.(С2H5OH) * η = 3 * 0,6 = 1,8 моль
m практич. (C2H5OH) = M(C2H5OH) * n практич. (C2H5OH) = 46 * 1,8 = 82,8 г
ответ: m (C2H5OH) = 82,8 г
0,88 г 4,32 г
х г 216 г
1. Сначала найдем чистую массу альдегида в растворе:
m(CxHy)=w(CxHy)*m(раствора)=0,22*4=0,88 г
2. Подставив в уравнение эту массу получим относительную молекулярную массу вещества:
при взаимодействии 0,88 г альдегида выпадает 4,32 г осадка, а
при -- // -- // -- х г______________________216 г, откуда
х=0,88*216/4,32=44 г
3. Теперь подставив в формулу определения относительной массы,получим уравнение:
Значит формула альдегида: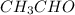 -уксусный альдегид
-уксусный альдегид