Дано:
m(раствора KOH)=100г.
ω%(KOH)=50%
m₁(H₂O)=300г.
ω₁%(соли)-?
1. Используем формулу:
ω%=m(в-ва)÷m(раствора)×100%
2. Определим массу гидроксида калия в растворе 200г.с массовой долй 50%:
m(KOH)=ω%(KOH)×m(раствораKOH )÷100%
m(соли)=50%×200г.÷100%=100г.
3. Определим новую массу раствора:
m₁(раствора KOH )=m(раствораKOH )+m₁(H₂O)
m₁(раствора соли)=200г.+300г.=500г.
4. Определим массовую долю нового раствора:
ω₁%(KOH )=m(KOH)÷m₁(раствора KOH )×100%
ω₁%(соли)=100г.÷500г.×100%=20%
5. ответ: если к 50% раствору массой 200г. добавить 300г воды, то массовая доля раствора станет 20%
Скорость реакции прямо пропорциональна константе скорости реакции, соответственно использую правило пропорции запишем
V2/V1=k2/k1, где
V2 - скорость реакции при искомой температуре
V1 - скорость реакции при температуре 40 С
k2 - константа скорости реакции при искомой температуре
k1 - константа скорости реакции при 40 C
выразим неизвестную
k2 = (V2*k1)/V1
запишем значения констант скоростей реакции через уравнение Аррениуса:
A* = * A*
приводим подобные, получаем
= *
логарифмируем (произведение заменяем сложением)
㏑ = ㏑ + ㏑
выносим степень за знак логарифма
* ㏑e = ㏑ - * ㏑e
получаем
-E/(RT2) = ㏑(V2/V1) - E/(RT2)
подставляем наши значения (не забываем кДж перевести в Дж)
21300/(8,314*313) = ㏑ (0,60/0,085) + 21300/8,314*Т1
8,185 = 1,954 +2561,944*T1
2561.944*T1 = 6.231
T1 = 411.16≈411 к
t1 = 411 - 273 = 138 °C
Дано:
m(раствора KOH)=100г.
ω%(KOH)=50%
m₁(H₂O)=300г.
ω₁%(соли)-?
1. Используем формулу:
ω%=m(в-ва)÷m(раствора)×100%
2. Определим массу гидроксида калия в растворе 200г.с массовой долй 50%:
m(KOH)=ω%(KOH)×m(раствораKOH )÷100%
m(соли)=50%×200г.÷100%=100г.
3. Определим новую массу раствора:
m₁(раствора KOH )=m(раствораKOH )+m₁(H₂O)
m₁(раствора соли)=200г.+300г.=500г.
4. Определим массовую долю нового раствора:
ω₁%(KOH )=m(KOH)÷m₁(раствора KOH )×100%
ω₁%(соли)=100г.÷500г.×100%=20%
5. ответ: если к 50% раствору массой 200г. добавить 300г воды, то массовая доля раствора станет 20%
Скорость реакции прямо пропорциональна константе скорости реакции, соответственно использую правило пропорции запишем
V2/V1=k2/k1, где
V2 - скорость реакции при искомой температуре
V1 - скорость реакции при температуре 40 С
k2 - константа скорости реакции при искомой температуре
k1 - константа скорости реакции при 40 C
выразим неизвестную
k2 = (V2*k1)/V1
запишем значения констант скоростей реакции через уравнение Аррениуса:
A*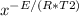 =
= 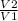 * A*
* A* 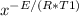
приводим подобные, получаем
логарифмируем (произведение заменяем сложением)
㏑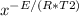 = ㏑
= ㏑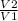 + ㏑
+ ㏑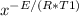
выносим степень за знак логарифма
получаем
-E/(RT2) = ㏑(V2/V1) - E/(RT2)
подставляем наши значения (не забываем кДж перевести в Дж)
21300/(8,314*313) = ㏑ (0,60/0,085) + 21300/8,314*Т1
8,185 = 1,954 +2561,944*T1
2561.944*T1 = 6.231
T1 = 411.16≈411 к
t1 = 411 - 273 = 138 °C