При дії на цинк масою 3,25 г достатньої кількості розчину сульфатної кислоти добули 1064 мл водню (н.у.). Який відносний вихід цього газу?
Відомо: m(Zn)=3,25 г, Vпракт.(H2)=1064 мл=1,064 л
Знайти: η-?
Розв'язування
іб
M(Zn)=65 г/моль
v(Zn)=m(Zn):M(Zn)=3,25 г : 65 г/моль=0,05 моль
Записуємо рівняння реакції:
Zn + H2SO4 = ZnSO4 + H2↑
За рівнянням реакції v(Zn):v(H2)=1:1, тому
v(Н2)=v(Zn)=0,05 моль
Vтеор.(H2)=v(H2)•Vм=0,05 моль•22,4 л/моль=1,12 л
η=Vпракт.(Н2):Vтеор.(Н2)=1,064 л : 1,12 л=0,95, або 95%
3,25 г х л
65 г 22,4 моль
M(Zn)=65 г/моль, маса 1 моль=65 г
За н.у. 1 моль газу займає об'єм 22,4 л
х=Vтеор.(H2)=3,25 г • 22,4 моль : 65 г=1,12 л
Відповідь: 95%
Объяснение:
Це правельно
1) 6I₂ + 12NaOH →10 NaI + 2NaIO₃ + 6H₂O ; реакция диспропорционирования
2) 2KMnO4 + 5H₂O₂ + 3H₂SO₄ → 2MnSO₄ + 5O₂ + K₂SO₄ +8H₂O ; межмолекулярная ОВР
1) I₂ + NaOH → NaI + NaIO₃ + H₂O
5| - восстановление (окислитель - I₂)
1| - окисление (восстановитель - I₂)
Добавляем к каждому аниону натрий:
Получаем:
6I₂ + 12NaOH →10 NaI + 2NaIO₃ + 6H₂O
Тип ОВР - реакция диспропорционирования (I₂ выступает и в роли окислителя, и в роли восстановителя)
2) KMnO4 + H₂O₂ + H₂SO₄ → MnSO₄ + O₂ + K₂SO₄ +H₂O
2| - восстановление (окислитель - KMnO4)
5| - окисление (восстановитель - H₂O₂ )
Добавляем к каждому аниону калий, а катиону - SO₄:
2KMnO4 + 5H₂O₂ + 3H₂SO₄ → 2MnSO₄ + 5O₂ + K₂SO₄ +8H₂O
Тип ОВР - межмолекулярная ОВР (окислитель и восстановитель - разные вещества)
При дії на цинк масою 3,25 г достатньої кількості розчину сульфатної кислоти добули 1064 мл водню (н.у.). Який відносний вихід цього газу?
Відомо: m(Zn)=3,25 г, Vпракт.(H2)=1064 мл=1,064 л
Знайти: η-?
Розв'язування
іб
M(Zn)=65 г/моль
v(Zn)=m(Zn):M(Zn)=3,25 г : 65 г/моль=0,05 моль
Записуємо рівняння реакції:
Zn + H2SO4 = ZnSO4 + H2↑
За рівнянням реакції v(Zn):v(H2)=1:1, тому
v(Н2)=v(Zn)=0,05 моль
Vтеор.(H2)=v(H2)•Vм=0,05 моль•22,4 л/моль=1,12 л
η=Vпракт.(Н2):Vтеор.(Н2)=1,064 л : 1,12 л=0,95, або 95%
іб
Записуємо рівняння реакції:
3,25 г х л
Zn + H2SO4 = ZnSO4 + H2↑
65 г 22,4 моль
M(Zn)=65 г/моль, маса 1 моль=65 г
За н.у. 1 моль газу займає об'єм 22,4 л
х=Vтеор.(H2)=3,25 г • 22,4 моль : 65 г=1,12 л
η=Vпракт.(Н2):Vтеор.(Н2)=1,064 л : 1,12 л=0,95, або 95%
Відповідь: 95%
Объяснение:
Це правельно
1) 6I₂ + 12NaOH →10 NaI + 2NaIO₃ + 6H₂O ; реакция диспропорционирования
2) 2KMnO4 + 5H₂O₂ + 3H₂SO₄ → 2MnSO₄ + 5O₂ + K₂SO₄ +8H₂O ; межмолекулярная ОВР
Объяснение:
1) I₂ + NaOH → NaI + NaIO₃ + H₂O
5|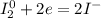 - восстановление (окислитель - I₂)
- восстановление (окислитель - I₂)
1|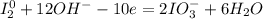 - окисление (восстановитель - I₂)
- окисление (восстановитель - I₂)
Добавляем к каждому аниону натрий:
Получаем:
6I₂ + 12NaOH →10 NaI + 2NaIO₃ + 6H₂O
Тип ОВР - реакция диспропорционирования (I₂ выступает и в роли окислителя, и в роли восстановителя)
2) KMnO4 + H₂O₂ + H₂SO₄ → MnSO₄ + O₂ + K₂SO₄ +H₂O
2|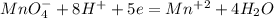 - восстановление (окислитель - KMnO4)
- восстановление (окислитель - KMnO4)
5|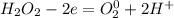 - окисление (восстановитель - H₂O₂ )
- окисление (восстановитель - H₂O₂ )
Добавляем к каждому аниону калий, а катиону - SO₄:
Получаем:
2KMnO4 + 5H₂O₂ + 3H₂SO₄ → 2MnSO₄ + 5O₂ + K₂SO₄ +8H₂O
Тип ОВР - межмолекулярная ОВР (окислитель и восстановитель - разные вещества)