В молекуле озона - три атома, кислорода - два атома. 3,6*10^20 против 2,4*10^13. Очевидно, в данной порции озона атомов больше, чем в данной порции кислорода.
Я не применял формулу = ; поскольку не указаны условия, а известное в пособиях значение константы Vm применяем для нормальных условий.
1. CH4 + 3 Cl2=CHCl3 + 3 HCl
V(CH4)=60*0.9=54 л
n(CH4)=54/22.4=2.41 моль
n(CH4)=n(CHCl3)=2.41 моль
m(CHCl3)теор=2.41*120=289.2 г
m(CHCl3)практ=0.7*289.2=202.44 г
V(CHCl3)=202.44/1.5=134.96 мл
ответ: 134,96 мл
2. CH4+2O2=CO2+2H2O
2C2H6+7O2=4CO2+6H2O
n(CH4)=5/22.4=0.223 моль
n1(O2)=2n(CH4)=0.223*2=0.446 моль
V1(O2)=0.446*22.4=10л
n(C2H6)=2/22.4=0.09 моль
n2(O2)=7n/2(C2H6)=7*0.09/2=0.315 моль
V2(O2)=0.315*22.4=7 л
V(O2)=10+7=17л
V(воздух)=17/0,21=80,9 л
ответ: 80,9 л
3. C3H8O=C3H6+H2O
C3H6+Br2=C3H6Br2
m(Br2)=0.032*200=6.4 г
n(Br2)=n(C3H6)=n(C3H8O)=6.4/160=0,04 моль
m(C3H8O)=0.04*60=2.4 г
ответ: 2,4 г
В порции озона. 3,6*10^20 против 2,4*10^13.
Объяснение:
Итак, основная формула - применяемая в этой задаче
N =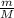 *Na, Na - число Авогадро, равное 6,022*10^23 моль⁻1, а N - число молекул
*Na, Na - число Авогадро, равное 6,022*10^23 моль⁻1, а N - число молекул
Для озона все проще - 0,0096 г/46 г/моль * 6,022*10^23 моль⁻1, ≈ 1,2044*10^20
Для кислорода все на шаг дольше, поскольку дан объем, а не масса. Эти две величины связаны соотношением V =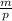 , отсюда m = V*p
, отсюда m = V*p
N =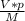 *Na = (0,00000448 м^3* 0,00143 г/м^3) * 6,022*10^23 моль⁻1, /32 г/моль ≈ 1,2056*10^13
*Na = (0,00000448 м^3* 0,00143 г/м^3) * 6,022*10^23 моль⁻1, /32 г/моль ≈ 1,2056*10^13
В молекуле озона - три атома, кислорода - два атома. 3,6*10^20 против 2,4*10^13. Очевидно, в данной порции озона атомов больше, чем в данной порции кислорода.
Я не применял формулу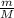 =
= 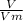 ; поскольку не указаны условия, а известное в пособиях значение константы Vm применяем для нормальных условий.
; поскольку не указаны условия, а известное в пособиях значение константы Vm применяем для нормальных условий.