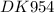Вкажіть значення відносної атомної маси Хлору, яку використовують при розрахунках відносних молекулярних мас речовин, до складу яких входить Хлор. Виберіть одну відповідь: a. 35,453 b. 35 c. 35,5 d. 36 ! только кто не знает, не пишите)
1) Для нахождения pH у буферного раствора для щелочи используется вот такая формула:
pH = 14 - рКд(NH₄OH) + lg (C(NH₄OH) / C(NH₃Cl))
2) Но в условий задачи есть объем и нормальная концентрация, значит мы найдем количества веществ , а потом их подставим на pH у буферного раствора, а то что надо найти отрицательный логарифм константы диссоциации щелочи, то это нужно найти по такой формуле:
Дано:
V(р-ра NH₄Cl) = 60 мл = 0,06 л
Cн(NH₄Cl) = 0,05 Н = 0,05 моль/л
V(р-ра NH₄OH) = 40 мл = 0,04 л
Cн(NH₄OH) = 0,1 Н = 0,1 моль/л
Кд(NH₄OH) = 1,8×10⁻⁵
-----------------------------------------------------
Найти:
pH - ?
1) Для нахождения pH у буферного раствора для щелочи используется вот такая формула:
pH = 14 - рКд(NH₄OH) + lg (C(NH₄OH) / C(NH₃Cl))
2) Но в условий задачи есть объем и нормальная концентрация, значит мы найдем количества веществ , а потом их подставим на pH у буферного раствора, а то что надо найти отрицательный логарифм константы диссоциации щелочи, то это нужно найти по такой формуле:
Cн(NH₄Cl) = n(NH₄Cl) / V(р-ра NH₄Cl) ⇒ n(NH₄Cl) = Cн(NH₄Cl) × V(р-ра NH₄Cl) = 0,05 моль/л × 0,06 л = 0,003 моль
Cн(NH₄OH) = n(NH₄OH) / V(р-ра NH₄OH) ⇒ n(NH₄OH) = Cн(NH₄OH) × V(р-ра NH₄OH) = 0,04 моль/л × 0,1 л = 0,004 моль
рКд(NH₄OH) = - lg Кд(NH₄OH) - отрицательный логарифм константы диссоциации щелочи
3) Теперь мы подставим все значения из 2) в формулу 1) , тогда мы получим:
pH = 14 + lg Кд(NH₄OH) + lg (n(NH₄OH) / n(NH₃Cl)) = 14 + lg (1,8×10⁻⁵) + lg (0,004 моль / 0,003 моль) ≈ 14 + (0,25 + (-5)) + lg (1,3) ≈ 14 + (0,25 - 5) + 0,11 ≈ 14 + (-4,75) + 0,11 ≈ 14 - 4,75 + 0,11 ≈ 9,36
ответ: pH = 9,36
Решено от :