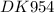Вычислить константы совмещенных равновесий.
из уравнений (каких возможно):
молекулярное: pb(no3)2+2naoh ---> pb(oh)2 (осадок) + 2nano3.
ионное: pb2²⁺ + (2no3⁻) + (2na⁺) + (2oh⁻) > pb(oh)2 (осадок) + (2na⁺)
и тот же осадок с избытком щелочи:
pb(oh)2 + 2naoh > na2[pb(oh)4]
Электронная конфигурация элементов 7А группы: ns2np5
F-2s22p5,Cl-3s23p5
Могут проявлять отрицательную степень -1 с в-вами имеющих большую электроотрицательность
Положительная степень +1,+3,+5,+7 с фторо,кислородом,азотом
У фтора всегда -1.
Физ.св-ства:
Фтор - Газ,светло-желтого цвета с резким запахом
Хло - газ,жёлто-зелёного цвета с резким,удушливым запахом
Бром - жидкость,тёмно-бурого цвета,резкий запах
Иод- твёрдое в-во,тёмно - серого цвета с резким запахом
б)С верху в низ уменьшаются
в) Окислительные св-ва:
1.С металлами(образуется соль)
2.С водородом(галогеноводороды)
От хлора к иоду окислительные св-ства ослабевают.
3.Взаимодействие с водой (образуются кислоты)
8.3.4
Дано:
V(р-ра AgNO₃) = 40 мл
ω(AgNO₃) = 6%
ρ(р-ра AgNO₃) = 1,05 гр/мл
V(HCl) = 250 мл = 0,25 л
Найти:
m(AgCl) - ?
1) Для начала мы запишем уравнение реакций, то что известно по условию задачи, именно по такой уравнений реакций мы будем пользоваться:
AgNO₃ + HCl → AgCl↓ + HNO₃
2) Теперь находим массу раствора у нитрата серебра, потом находим его массу чистого вещества у нитрата серебра:
m(р-ра AgNO₃) = V(р-ра AgNO₃)×ρ(р-ра AgNO₃) = 40 мл × 1,05 гр/мл = 42 гр
m(AgNO₃) = (m(р-ра AgNO₃)×ω(AgNO₃))/100% = (42 гр × 6%)/100% = 42 гр × 0,06 = 2,52 гр
3) Теперь находим количества вещества у нитрата серебра и у соляной кислоты, и мы потом определим какой из них в избытке и в недостатке:
M(AgNO₃) = 108 + 14 + 16×3 = 122 + 48 = 170 гр/моль
Vm = 22,4 л/моль
n(AgNO₃) = m(AgNO₃)/M(AgNO₃) = 2,52 гр / 170 гр/моль ≈ 0,0148 моль - в избытке
n(HCl) = V(HCl)/Vm = 0,25 л / 22,4 л/моль ≈ 0,0112 моль - в недостатке
Следовательно:
m(AgCl) = n(HCl) = 0,0112 моль
4) Теперь находим массу образовавшегося осадка:
M(AgCl) = 108 + 35,5 = 143,5 гр/моль
m(AgCl) = n(AgCl)×M(AgCl) = 0,0112 моль × 143,5 гр/моль = 1,6072 гр ≈ 1,6 гр
ответ: m(AgCl) = 1,6 гр
Решено от :