Составим уравнение и подпишем под ним то, что дано:
С₂Н₅ОН + Na => C₂H₅ONa + H₂↑
69 г х г
m (Na) = M×n
m (Na) = 22,98 г\моль 1 моль= 22,98 грамм.
m (H₂) = M×n
m (H₂) = 1 г\моль ×2 моль= 2 грамма
Составляем пропорцию:
69 г (Na) - х г (H₂)
22,98 г (Na) - 2 г (H₂)
Отсюда => = 6,005 грамм.
ответ: 6,005 грамм
Объяснение:
Т.к в уравнении мы имеем один Na, и зная его молярную массу из таблицы Менделеева 22,98 г\моль, то можем найти его массу:
Аналогично находим массу водорода
В уравнении у нас H₂, значит количество водорода n=2 моль, молярная масса M(H) = 1 г\моль
Составим уравнение и подпишем под ним то, что дано:
С₂Н₅ОН + Na => C₂H₅ONa + H₂↑
69 г х г
m (Na) = M×n
m (Na) = 22,98 г\моль 1 моль= 22,98 грамм.
m (H₂) = M×n
m (H₂) = 1 г\моль ×2 моль= 2 грамма
Составляем пропорцию:
69 г (Na) - х г (H₂)
22,98 г (Na) - 2 г (H₂)
Отсюда =>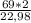 = 6,005 грамм.
= 6,005 грамм.
ответ: 6,005 грамм
Объяснение:
Т.к в уравнении мы имеем один Na, и зная его молярную массу из таблицы Менделеева 22,98 г\моль, то можем найти его массу:
m (Na) = M×n
m (Na) = 22,98 г\моль 1 моль= 22,98 грамм.
Аналогично находим массу водорода
В уравнении у нас H₂, значит количество водорода n=2 моль, молярная масса M(H) = 1 г\моль
m (H₂) = M×n
m (H₂) = 1 г\моль ×2 моль= 2 грамма
2) CuSO4 + 2HNO3 -- Cu(NO3)2 + H2SO4 всё растворяется
3) 2FeCl3 + 3Zn(NO3)2 -- 2Fe(NO3)3 + 3ZnCl2 всё растворяется
4) NiSO4 + KNO3 -- Ni(NO3)2 + K2SO4 всё растворяется
мб чего-то я не понимаю..
1) BaCO3 + HCl-- BaCl2 + H2O + CO2 выделения углекислого газа
2) Ca(OH)2 + Na2CO3 -- CaCO3 + 2NaOH карбонат кальция выпадает в осадок
3) CuO + H2SO4 -- CuSO4 + H2O медный купорос и вода
4) Al(OH)3 + KOH -- K|Al(OH)4| +H2O тетрагидроксоалюминат калия и вода, комплексная соль т.к. амфотерный гидроксид