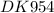1. SnO2. Валентность кислорода всегда равна 2. Значит, умножаем индекс кислорода на его валентность и получаем 4 - именно соолько атомов кислорода присоединяет к себе один атом олова. ответ: (4)Sn(2)O2. 2. PCl3. Здесь делаем крест-накрест: у фосфора индекс 1, у хлора индекс 3, значит, валентность фосфора 3, а хлора - один. ответ: (3)P(1)Cl3. 3.N2O. Здесь снова определим по кислороду: у него валентность 2, значит, два атома азота присоединяют к себе один атом кислорода. ответ: (1)N2(2)O. 4. Fe2S3. Ну здесь опять-таки просто крест-накрест. ответ: (3)Fe2(2)S3. 5. Ar2O. Тут снова кислород, значит ответ: (1)Ar2(2)O.
Дано:
m(Al₂O₃) = 20,4 гр
η(соли) = 90%
Найти:
m прак.(соли) - ?
1) Для начала мы запишем уравнение реакций то что известно по условию, именно по такой уравнений реакций мы будем пользоваться:
Al₂O₃ + 2NaOH → 2NaAlO₂ + H₂O
2) Далее мы находим количества вещества у оксида алюминия, а потом у образовавшейся соли из уравнения реакций:
M(Al₂O₃) = 27×2 + 16×3 = 54 + 48 = 102 гр/моль
n(Al₂O₃) = m(Al₂O₃)/M(Al₂O₃) = 20,4 гр / 102 гр/моль = 0,2 моль ⇒ n(NaAlO₂) = 2n(Al₂O₃) = 2×0,2 моль = 0,4 моль
3) Теперь находим теоретическую массу соли:
M(NaAlO₂) = 23 + 27 + 16×2 = 50 + 32 = 82 гр/моль
m теор.(NaAlO₂) = n(NaAlO₂)×M(NaAlO₂) = 0,4 моль × 82 гр/моль = 32,8 гр
4) Далее находим практическую массу соли:
η(соли) = m прак.(NaAlO₂) / m теор.(NaAlO₂) × 100% ⇒
m прак.(NaAlO₂) = (m теор.(NaAlO₂) × η(соли))/100% = (32,8 гр × 90%)/100% = 32,8 гр × 0,9 = 29,52 гр
ответ: m прак.(NaAlO₂) = 29,52 гр
Решено от :