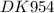Задание 6. Определить валентности элементов по формуле вещества: 1) Cr2O3 ; 2) CH4 ; 3) MnO2 ; 4) BaS 5) K2S; 6) B2S3
Задание 7. Составить формулы сложных веществ, состоящих из следующих химических элементов: 1)свинца (IV) и водорода; 2) фосфора (III) и бария 3) серы (IV) и кислорода; 4) брома (I) и хрома (III); 5) золота (III) и кислорода; 6) брома (V) и кислорода
Задание 8. Вычислите массовые доли всех химических элементов в K2FeO4
Задание 9. Расставьте коэффициенты в уравнениях следующих реакций и определите их тип: а) Fe + Cl2→ FeCl3 б) NaI + Br2 → NaBr + I2 в) NH3 → N2 + H2 г) Al + C →Al4C3
Для нахождения активности ионов металла в растворе единице для определения величины электродного потенциала используется уравнение Нернста, именно по такой формуле мы найдем потенциал кальциевого электрода:
- уравнение Нернста
E°(Ca²⁺/Ca) = -2,87 В - из табличного значения про "Стандартные электродные потенциалы"
F = 96500 Кл/моль - Число Фарадея
R = 8,31 Дж/(моль×К) - Универсальная газовая постоянная
n = 2 - Валентность иона кальция
E(Ca²⁺/Ca) = -2,87 В + (8,31 Дж/(моль×К) × 293 К) / (2 × 96500 Кл/моль) × lg 70 = -2,87 В + (2434,83 Дж/моль) / (193000 Кл/моль) × lg(10×7) ≈ -2,87 В + 0,0126 Дж/Кл × (lg 10 + lg 7) ≈ -2,87 В + 0,0126 В × (1 + 0,845) ≈ -2,87 В + 0,0126 В × 1,845 ≈ - 2,87 В + 0,0233 В ≈ -2,8467 В ≈ -2,85 В
1) Cu(OH)2 +2 HNO3 = Cu(NO3)2 +2 H2O
Cu(OH)2 + 2H(+) + 2NO3(-) = Cu(+2) + 2NO3(-) + 2H2O
Cu(OH)2 + 2H(+) = Cu(+2) + 2H2O
2) CuCl2 + 2NaNO3 = Cu(NO3)2 + 2NaCl
Cu(+2) + 2Cl(-) + 2Na(+) + 2NO3(-) = Cu(+2) + 2NO3(-) + 2Na(+) + 2Cl(-) реакция не идёт
3) H2SO4 + MgSO3 = MgSO4 + SO3 + H2O
2H(+) + SO4(-2) + MgSO3 = Mg(+2) + SO4(-2) + SO3 + H2O
2H(+) + MgSO3 = Mg(+2) + SO3 + H2O
4) Al2O3 + 6HNO3 = 2Al(NO3)3 +3H2O
Al2O3 + 6H(+) + 6NO3(-) = 2Al(+3) + 6NO3(-) + 3H2O
Al2O3 + 6H(+) = 2Al(+3) + 3H2O
5) Na2CO3 + Ca(NO3)2 = 2NaNO3 + CaCO3
2Na(+) + CO3(-2) + Ca(+2) + 2NO3(-) = 2Na(+) + 2NO3(-) + CaCO3
Ca(+2) + CO3(-2) = CaCO3
Дано:
T = 293 К
[Ca²⁺] = 70 моль/л
Найти:
E(Ca²⁺/Ca) - ?
Для нахождения активности ионов металла в растворе единице для определения величины электродного потенциала используется уравнение Нернста, именно по такой формуле мы найдем потенциал кальциевого электрода:
E°(Ca²⁺/Ca) = -2,87 В - из табличного значения про "Стандартные электродные потенциалы"
F = 96500 Кл/моль - Число Фарадея
R = 8,31 Дж/(моль×К) - Универсальная газовая постоянная
n = 2 - Валентность иона кальция
E(Ca²⁺/Ca) = -2,87 В + (8,31 Дж/(моль×К) × 293 К) / (2 × 96500 Кл/моль) × lg 70 = -2,87 В + (2434,83 Дж/моль) / (193000 Кл/моль) × lg(10×7) ≈ -2,87 В + 0,0126 Дж/Кл × (lg 10 + lg 7) ≈ -2,87 В + 0,0126 В × (1 + 0,845) ≈ -2,87 В + 0,0126 В × 1,845 ≈ - 2,87 В + 0,0233 В ≈ -2,8467 В ≈ -2,85 В
ответ: E(Ca²⁺/Ca) = -2,85 В
Решено от :