1-г, 2-б, 3-в, 4-а, 5-б, 6-а, 7-г, 8-в, 9-а,г,
10 - -с ярко выраженными кислотными свойствами
11. - вещество А - оксид фосфора(V)
- вещество В - ортофосфорная кислота
х л у л 3 моль
12.
22,4 л 22,4 л 2 моль
а) при взаимодействии 22,4 л водорода образуется 2 моль хлороводорода, а
при -- // -- х л_____________________3 моль, откуда
х=22,4*3/2= 33,6 л
б) так как из уравнения видно,что объемные части реагирующих газов равны,значит:
х=у=33,6 л
13. Белый,красный и черный
2) 2K+2H2O = 2KOH + H2
3) 2KOH + (NH4)2CO3 = K2CO3 + 2NH3(газ) + 2H2O
4) K2CO3 + 2HCl = 2KCl + CO2 + H2O
||) 1) 1 - ый электролиз расплава солей.
2KCl =[электролиз] 2K(+) + 2Cl2(-).
2) 2-ой это получение щелочных металлов проводят электролиз расплавов их гидроксидов : 4NaOH = 4Na + 2H2O + O2
3) 3-ий это щелочной металл может быть восстановлен из соответствующего хлорида или бромида кальцием, магнием, кремнием и др. восстановителями при нагревании под вакуумом до 600-900 °C:
2Cs2CO3 + Zr = 4Cs + ZrO2 + 2CO2
1-г, 2-б, 3-в, 4-а, 5-б, 6-а, 7-г, 8-в, 9-а,г,
10 -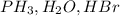 -с ярко выраженными кислотными свойствами
-с ярко выраженными кислотными свойствами
11.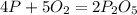 - вещество А - оксид фосфора(V)
- вещество А - оксид фосфора(V)
х л у л 3 моль
12.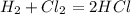
22,4 л 22,4 л 2 моль
а) при взаимодействии 22,4 л водорода образуется 2 моль хлороводорода, а
при -- // -- х л_____________________3 моль, откуда
х=22,4*3/2= 33,6 л
б) так как из уравнения видно,что объемные части реагирующих газов равны,значит:
х=у=33,6 л
13. Белый,красный и черный