Завдання 1. Порівняйте, чим подібні та чим відрізня ються між собою цукор и кухонна сіль. Відповідь підтвердьте дослідженнями властивостей цих сполук. Завдання 2. Насипте в пробирку порошки заліза масою 3,5 гі сирки масою 2 г. Перемішайте ix. Укріпіть бірку й нагрійте в полум'ї спиртівки, дотримуючись правил нагрівання. Що гаєте? Яке явище відбулося? Они шіть ваш
Завдання 3. Знайдіть розчини купрум (ІІ) сульфату CuSO4 і натрій гідроксиду NaOH серед виданих вам речо вин. Налийте в пробірку первый розчин об'ємом 1 мл і Долийте такий самий об'єм другого. Що гаєте? Яке явище відбулося? Відповідь обгрунтуйте.
Получено 19,6 г сульфата хрома (III) Cr₂(SO₄)₃ и 3,36 л водорода
Объяснение:
Дано: m(Cr) = 5,2 г; m(H₂SO₄) = 98 г.
Найти: m(Cr₂(SO₄)₃); V(H₂).
Решение.
2Cr + 3H₂SO₄ → Cr₂(SO₄)₃ + 3H₂
По уравнению реакции хром и серная кислота реагируют в отношении 2 моль : 3 моль. Найдем количество вещества в заданных массах:
Молярная масса M(Cr) = 52 г/моль
Количество вещества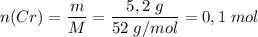 .
.
M(H₂SO₄) = 2 + 32 + 64 = 98 г/моль
На 0,1 моль Cr требуется 0,15 моль H₂SO₄. Серная кислота дана в избытке. Расчет ведем по хрому.
По уравнению реакции
n(Cr) : n(Cr₂(SO₄)₃) : n(H₂) = 2 : 1 : 3 = 0,1 моль : 0,05 моль : 0,15 моль
Найдем массу образовавшегося сульфата хрома (III) Cr₂(SO₄)₃
M(Cr₂(SO₄)₃) = 2*52 + 32*3 + 16*4*3 = 104 + 96 + 192 = 392 г/моль
m(Cr₂(SO₄)₃) = n*M = 0,05 моль * 392 г/моль = 19,6 г.
Найдем объем выделившегося водорода:
V(H₂) = n*Va = 0,15 моль * 22,4 л/моль = 3,36 л.
2. Физический (онже промышленный) основан на том факте, что температура кипения жид кого кислорода (90.19 градусов Кельвина или около -183 градусов Цельсия) выше, чем азота (63,29 К) . Воздух, состоящий примерно на 4/5 из азота и на 1/5 из кислорода сжижают, а потом из жидкого воздуха испаряют кислород и закачивают во всем известные синие , а остаток (жидкий азот) так же используют
если интересует сбор газов, выделяющихся при химических реакций обычно используют вытеснение более плотного вещества (воды) из некой склянки, которую еще называют "колокол".