1. Что происходит при взаимодействии цинка с соляной кислотой? Составьте словесное уравнение химической реакции.
2. Опишите физические свойства водорода, непосредственно на-
блюдаемые при проведении опыта.
3. Опишите, как можно распознать водород.
4. Зачем нужно проверять водород на "чистоту"?
1) Найдем массы чистой (безводной) серной кислоты в растворах:
ω=m(в-ва)÷m(р-ра)×100% ⇒ m(в-ва)=ω×m(р-ра)÷100%
m₁(H₂SO₄)=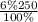 =15 г H₂SO₄
=15 г H₂SO₄
m₂(H₂SO₄)=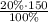 =30 г H₂SO₄
=30 г H₂SO₄
Масса образовавшегося раствора:
m(р-ра)= m₁(р-ра)+m₂(р-ра) = 250+150 = 400 г
Общая масса чистой (безводной) кислоты:
m(H₂SO₄)=m₁(H₂SO₄)+m₂(H₂SO₄)=15+30=45 г
Массовая доля H₂SO₄ в образовавшемся растворе:
ω=m(в-ва)÷m(р-ра)×100% ⇒ ω=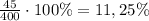
ответ: массовая доля кислоты 11,25%.
2) 2Н₂ + О₂ = 2Н₂О
V(O₂)= 0,6·22,4= 13,44 л
Vm(Н₂)= 22,4 л/моль
Vm(О₂)= 22,4 л/моль
V(Н₂)= х л
V(О₂)= 13,44 л
Расчет по уравнению реакции:
2×22,4 л Н₂ реагирует с 22,4 л О₂
х л Н₂ реагирует с 13,44 л О₂
ответ: водорода потребуется 26,88 л.
3) а) HCl - ковалентная полярная связь
б) O₂ - ковалентная неполярная связь
в) CaF - ионная связь
1) Скорость реакции зависит от природы реагирующих веществ. Проще говоря, разные вещества реагируют с разной скоростью. Например, цинк бурно реагирует с соляной кислотой, а железо довольно медленно.
2) Скорость реакции тем больше, чем выше концентрация веществ. С сильно разбавленной кислотой цинк будет реагировать значительно дольше.
3) Скорость реакции значительно повышается с повышением температуры. Например, для горения топлива необходимо его поджечь, т.е. повысить температуру. Для многих реакций повышение температуры на 10° C сопровождается увеличением скорости в 2–4 раза.
4) Скорость гетерогенных реакций увеличивается с увеличением поверхности реагирующих веществ. Твердые вещества для этого обычно измельчают. Например, чтобы порошки железа и серы при нагревании вступили в реакцию, железо должно быть в виде мелких опилок.
Обратите внимание, что в данном случае подразумевается формула (1)! Формула (2) выражает скорость на единице площади, следовательно не может зависеть от площади.
5) Скорость реакции зависит от наличия катализаторов или ингибиторов.