2. Написати рівняння реакцій одержання сполук п’ятьма
Приклад. Карбонат кальцію СаСО3.
1. Сa(ОН)2+ Н 2СО3 = СаСО3 + 2 Н 2О;
2. СaО + СО2 = СаСО3;
3. Сa(НСО3)2 + Сa(ОН)2 = СаСО3 + 2 Н 2О;
4. Сa(ОН)2+СО2 = СаСО3 + Н 2О;
5. СaО + Н 2СО3 = СаСО3 + Н 2О.
1. Фосфат кальцію.
2. Сульфат кальцію.
3. Хлорид цинку.
4. Карбонат амонію.
5. Нітрат цинку.
6. Сульфат барію.
7. Хлорид купруму (І).
8. Сульфат феруму (ІІІ)
9. Сульфід купруму (II).
10.Гідрофосфат магнію.
11.Сульфат магнію.
12.Нітрат купруму.
13.Сульфід феруму (ІІ).
14. Сульфат феруму (ІІІ).
15. Хлорид феруму (ІІІ).
1. CaO + H₂O = Ca(OH)₂
2.m(Ca(OH)₂=m(CaO) + m(H₂O) = 28кг. + 9кг.=38кг.
3. ответ: образуется 38кг. гашенной извести.
Задачу можно решить используя взаимосвязи понятий: молярная масса, моль, масса. Не всегда будет образовываться одно вещество, поэтому решение ниже оставьте, как алгоритм решения других задач.
Дано:
m(CaO)=28кг.
m(H₂O)=9кг.
m(Ca(OH)₂-?
1. Определим молярную массу не гашенной извести (оксида кальция) и ее количество вещества в 28кг.
M(CaO)=40+16=56кг./кмоль
n(CaO)=m(CaO)÷M(CaO)=28кг.÷56кг./кмоль=0,5кмоль
2. Определим молярную массу воды и ее количество вещества в 9кг.:
M(H₂O)=2+16=18кг./кмоль
n(H₂O)=m(H₂O)÷M(H₂O)=9кг. ÷ 18кг./кмоль=0,5кмоль.
3. Запишем уравнение реакции:
CaO + H₂O = Ca(OH)₂
4. Анализируем уравнение реакции 1кмоль оксида кальция взаимодействует с 1кмоль воды. В условии задачи 0,5кмоль оксида кальция и 0,5кмоль воды, значит они израсходуются полностью. Дальше задачу можно решать используя или оксид кальция или воду. Количество вещества гидроксида кальция(гашенной извести) 0,5 кмоль.
n[Ca(OH)₂] =0.5 кмоль
5. Определим молярную массу гидроксида кальция и его массу количеством вещества 0,5кмоль:
M[Ca(OH)₂] =40+(16+2)x2=76кг./кмоль
m[Ca(OH)₂] =n[Ca(OH)₂] x M[Ca(OH)₂] =0,5кмольх76кг./кмоль=38кг.
6. ответ: образуется 38кг. гашенной извести.
Дано:
а) ω(Cu) = 47,4%
ω(Cl) = 52,6%
б) ω(Fe) = 34,5%
ω(Cl) = 65,5%
--------------------------------
Найти:
а) формулу соли - ?
б) формулу соли - ?
а) Запишем формулу соли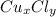
По условии дано, что в 100 единиц массы вещества содержится 47,4% меди и 52,6% хлора. Находим число атомов каждого элемента в 100 единицах вещества, делим их числа на относительные атомные массы:
Пусть m(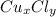 ) = 100 гр, тогда:
) = 100 гр, тогда:
m(Cu) = ω(Cu)×m(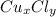 )/100% = 47,4% × 100 гр/100% = 0,474 × 100 гр = 47,4 гр
)/100% = 47,4% × 100 гр/100% = 0,474 × 100 гр = 47,4 гр
m(Cl) = ω(Cl)×m(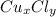 )/100% = 52,6% × 100 гр/100% = 0,526 × 100 гр = 52,6 гр
)/100% = 52,6% × 100 гр/100% = 0,526 × 100 гр = 52,6 гр
M(Cu) = 64 гр/моль M(Cl) = 35,5 гр/моль
x = m(Cu)/M(Cu) = 47,4/64 ≈ 0,74 - атомов меди (Cu)
y = m(Cl)/M(Cl) = 52,6/35,5 ≈ 1,48 - атомов хлора (Cl)
Определим соотношение чисел атомов в формуле вещества:
x : y = 0,74 : 1,48 = 1 : 2
Следовательно мы получаем формулу соли - CuCl₂.
б) Запишем формулу соли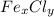
По условии дано, что в 100 единиц массы вещества содержится 34,5% железа и 65,5% хлора. Находим число атомов каждого элемента в 100 единицах вещества, делим их числа на относительные атомные массы:
Пусть m(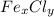 ) = 100 гр, тогда:
) = 100 гр, тогда:
m(Fe) = ω(Fe)×m(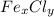 )/100% = 34,5% × 100 гр/100% = 0,345 × 100 гр = 34,5 гр
)/100% = 34,5% × 100 гр/100% = 0,345 × 100 гр = 34,5 гр
m(Cl) = ω(Cl)×m(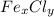 )/100% = 65,5% × 100 гр/100% = 0,655 × 100 гр = 65,5 гр
)/100% = 65,5% × 100 гр/100% = 0,655 × 100 гр = 65,5 гр
M(Fe) = 56 гр/моль M(Cl) = 35,5 гр/моль
x = m(Fe)/M(Fe) = 34,5/56 ≈ 0,62 - атомов меди (Fe)
y = m(Cl)/M(Cl) = 65,5/35,5 ≈ 1,85 - атомов хлора (Cl)
Определим соотношение чисел атомов в формуле вещества:
x : y = 0,62 : 1,85 ≈ 1 : 3
Следовательно мы получаем формулу соли - FeCl₃.
ответ: а) CuCl₂ ; б) FeCl₃