Яка сіль утвориться внаслідок взаємодії хлоридної кислоти з ферум(ІІ) гідроксидом? Написати рівняння реакції, урівняти її, підкреслити сіль, підписати її назву та обчислити її відносну молекулярну масу.
За подальшого нагрівання утворюється осад цегляно-червоного кольору:
2CuOH = Cu2O(ocaд) + Н2О
блакитний купрум (ІІ) гідроксид розчиниться, а замість нього утвориться оранжевий осад купрум (І) гідроксиду, який за подальшого нагрівання набуде цегляно-червоного кольору.
Висновок: Щоб виявити глюкозу нам необхіден такий реактив як купрум (ІІ) гідроксид. Зазначимо те, що для виявлення альдегідної групи треба здійснити нагрівання
Объяснение:
1. З нерозчинним у воді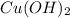 блакитного кольору утворює комплексну сполуку яскраво-блакитного кольору(прикладаю реакцію)
блакитного кольору утворює комплексну сполуку яскраво-блакитного кольору(прикладаю реакцію)
Висновок: для якісного визначення глюкози використовують важкі метали.
2. Етаналь можна визначити за до реакції "срібного дзеркала":
СН3-СНО + 2[Ag(NH3)2OH = CH3COOH + 2Ag(осад) + 4NH3 + H2O
на стінках пробірки утворюється тонкий шар срібла.
Висновок: для виявлення альдегідів можна узяти аміачний розчин аргентум(І) оксиду
Сахарозу можна виявити за реакцією:
С12H22O11 + Ca(OH)2 = C12H22O11*CaO + H2O
Cпостереження: утворення безбарвного розчину кальцій сахариту
Висновок: для виявлення сахарози необхідно узяти кальцій гідроксид
3. Для виявлення гідроксильної групи:
прикладаю фото
утворюється прозорий розчин купрум(ІІ) глюконату синього кольору
Для виявлення альдегідної групи:
CH2OH-(CHOH)4--CHO + Cu(OH)2 =(нагрівання) CH2OH-(CHOH)4-COOH + CuOH + H2O
За подальшого нагрівання утворюється осад цегляно-червоного кольору:
2CuOH = Cu2O(ocaд) + Н2О
блакитний купрум (ІІ) гідроксид розчиниться, а замість нього утвориться оранжевий осад купрум (І) гідроксиду, який за подальшого нагрівання набуде цегляно-червоного кольору.
Висновок: Щоб виявити глюкозу нам необхіден такий реактив як купрум (ІІ) гідроксид. Зазначимо те, що для виявлення альдегідної групи треба здійснити нагрівання
m'(Fe) = 100 г
ω(Fe) = 95.2% или 0,952
Найти:
m(FeS) - ?
1) Находим массу чистого железа (без примесей)
m(Fe) = m'(Fe)*ω(Fe)
m(Fe) = 100 г*0,952 = 95,2 г
2) Вычисляем количество вещества железа:
M(Fe) = 56 г/моль
n(Fe) = m(Fe)/M(Fe)
n(Fe) = 95,2 г/56 г/моль = 1,7 моль
3) Составляем уравнение реакции и по нем находим массу сульфида железа:
Fe + S = FeS
Из стехиометрических коэффициентов уравнения реакции следует, что n(FeS)=n(Fe) = 1,7 моль
M(FeS) = 88 г/моль
m(FeS) = n(FeS)*M(FeS)
m(FeS) = 1.7 моль*88 г/моль = 149,6 г
ответ: 149,6 г