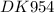Дми́трий Ива́нович Менделе́ев — русский учёный-энциклопедист: химик, физикохимик, физик, метролог, экономист, технолог, геолог, метеоролог, нефтяник, педагог, воздухоплаватель,приборостроитель. Профессор Санкт-Петербургского университета; член-корреспондент по разряду «физический» Императорской Санкт-Петербургской Академии наук. Среди наиболее известных открытий — периодический закон химических элементов, один из фундаментальных законов мироздания, неотъемлемый для всего естествознания. Автор классического труда «Основы химии». 1841 — поступил в тобольскую гимназию.1855 — окончил физико-математический факультет Главного педагогического института в Санкт-Петербурге.1855 — старший учитель естественных наук Симферопольской мужской гимназии. По петербургского врача Н. Ф. Здекауэра в середине сентября Дмитрия Менделеева осмотрел Н. И. Пирогов, констатировавший удовлетворительное состояние пациента: «Вы нас обоих переживёте»[20].1855—1856 — старший учитель гимназии при Ришельевском лицее в Одессе.1856 — блестяще защитил диссертацию «на право чтения лекций» — «Строение кремнезёмных соединений» (оппоненты А. А. Воскресенский и М. В. Скобликов), с успехом прочёл вступительную лекцию «Строение силикатных соединений»; в конце января отдельным изданием в Петербурге вышла в свет кандидатская диссертация Д. И. Менделеева «Изоморфизм в связи с другими отношениями кристаллической формы к составу»[21]; 10 октября присвоена учёная степень магистрахимии.1857 — 9 января утверждён в звании приват-доцента Императорского Санкт-Петербургского университета по кафедре химии.1857—1890 — преподавал в Императорском Санкт-Петербургском университете (с 1865 года — профессор химической технологии, с 1867 — профессор общей химии) — во 2-м кадетском корпусе читает лекции по химии; одновременно в 1863—1872 годах — профессор Санкт-Петербургского технологического института, в1863—1872 годах руководил химической лабораторией института, также одновременно преподавал в Николаевских инженерных академии и училище; — в Институте Корпуса инженеров путей сообщения.1859—1861 — находился в научной командировке в Германии
Далее мы где решали уравнение полуреакций мы их находим в табличном значений, потом находим ЭДС и в итоге определим самопроизвольного протекания реакции между ними:
E(окислителя) = 1,33 В E(восстановителя) = 0,84 В
ε = E(окислителя) - E(восстановителя) = 1,33 В - 0,84 В = 0,49 В
ΔG = -ε = -(+0,49 В) = -0,49 В - протекает самопроизвольно
Теперь находим констант равновесия из полуреакций по уравнению Нернста:
lg K = ( n×(E(окислителя) - E(восстановителя) ) / 0,059 , где
1841 — поступил в тобольскую гимназию.1855 — окончил физико-математический факультет Главного педагогического института в Санкт-Петербурге.1855 — старший учитель естественных наук Симферопольской мужской гимназии. По петербургского врача Н. Ф. Здекауэра в середине сентября Дмитрия Менделеева осмотрел Н. И. Пирогов, констатировавший удовлетворительное состояние пациента: «Вы нас обоих переживёте»[20].1855—1856 — старший учитель гимназии при Ришельевском лицее в Одессе.1856 — блестяще защитил диссертацию «на право чтения лекций» — «Строение кремнезёмных соединений» (оппоненты А. А. Воскресенский и М. В. Скобликов), с успехом прочёл вступительную лекцию «Строение силикатных соединений»; в конце января отдельным изданием в Петербурге вышла в свет кандидатская диссертация Д. И. Менделеева «Изоморфизм в связи с другими отношениями кристаллической формы к составу»[21]; 10 октября присвоена учёная степень магистрахимии.1857 — 9 января утверждён в звании приват-доцента Императорского Санкт-Петербургского университета по кафедре химии.1857—1890 — преподавал в Императорском Санкт-Петербургском университете (с 1865 года — профессор химической технологии, с 1867 — профессор общей химии) — во 2-м кадетском корпусе читает лекции по химии; одновременно в 1863—1872 годах — профессор Санкт-Петербургского технологического института, в1863—1872 годах руководил химической лабораторией института, также одновременно преподавал в Николаевских инженерных академии и училище; — в Институте Корпуса инженеров путей сообщения.1859—1861 — находился в научной командировке в Германии
K₂Cr₂O₇ + KNO₂ + H₂SO₄ → Cr₂(SO₄)₃ + KNO₃ + K₂SO₄ + H₂O
2K⁺ + Cr₂O₇²⁻ + K⁺ + NO₂⁻ + 2H⁺ + SO₄²⁻ → 2Cr³⁺ + 3SO₄²⁻ + K⁺ + NO₃⁻ + 2K⁺ + SO₄²⁻ + H₂O
Cr₂O₇²⁻ + NO₂⁻ + 2H⁺ → 2Cr³⁺ + NO₃⁻ + H₂O
Cr₂O₇²⁻ + 14H⁺ + 6e⁻ → 2Cr³⁺ + 7H₂O | 6 | | 1 | - окислитель
| | 6 | |
NO₂⁻ + H₂O - 2е⁻ → NO₃⁻ + 2H⁺ | 2 | | 3 | - восстановитель
---------------------------------------------------------------------------------------------------------
Cr₂O₇²⁻ + 14H⁺ + 6e⁻ + 3NO₂⁻ + 3H₂O - 6е⁻ → 2Cr³⁺ + 7H₂O + 3NO₃⁻ + 6H⁺
Cr₂O₇²⁻ + 3NO₂⁻ + 8H⁺ → 2Cr³⁺ + 4H₂O + 3NO₃⁻
2K⁺ + Cr₂O₇²⁻ + 3K⁺ + 3NO₂⁻ + 8H⁺ + 4SO₄²⁻ → 2Cr³⁺ + 3SO₄²⁻ + 3K⁺ + 3NO₃⁻ + 2K⁺ + SO₄²⁻ + 4H₂O
В итоге получаем:
K₂Cr₂O₇ + 3KNO₂ + 4H₂SO₄ → Cr₂(SO₄)₃ + 3KNO₃ + K₂SO₄ + 4H₂O
Далее мы где решали уравнение полуреакций мы их находим в табличном значений, потом находим ЭДС и в итоге определим самопроизвольного протекания реакции между ними:
E(окислителя) = 1,33 В E(восстановителя) = 0,84 В
ε = E(окислителя) - E(восстановителя) = 1,33 В - 0,84 В = 0,49 В
ΔG = -ε = -(+0,49 В) = -0,49 В - протекает самопроизвольно
Теперь находим констант равновесия из полуреакций по уравнению Нернста:
lg K = ( n×(E(окислителя) - E(восстановителя) ) / 0,059 , где
n - общее число электронов
lg K = ( 6×(1,33 - 0,84) ) / 0,059
lg K = ( 6×0,49 ) / 0,059
lg K = 2,94 / 0,059
lg K ≈ 49,83 ⇒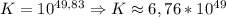
ответ: ε = 0,49 В, ΔG = -0,49 В ,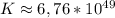
Решено от :